题目内容
1.一小块钠置于氧气流中加热一段时间后得一固体混合物A.然后将A置于盛满水并倒置于水中的容器中,反应结束后测得产生气体质量为0.5g.用电火花引爆气体.冷却后剩余氧气质量为0.32g,生成的溶液用含HCl 3.65g稀盐酸恰好中和,求:(1)原来金属钠的质量:
(2)固体A中各组分的质量.
分析 反应结束后测得产生气体质量为0.5g.用电火花引爆气体.冷却后剩余氧气质量为0.32g,则氢气的质量为(0.5g-0.32g)×$\frac{2}{18}$=0.02g,与水反应生成氧气的质量为0.5g-0.02g=0.48g,生成的溶液用含HCl 3.65g稀盐酸恰好中和,n(HCl)=$\frac{3.65g}{36.5g/mol}$=0.1mol,则反应后溶液中n(Na+)=0.1mol,结合2Na+2H2O=2NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑计算.
解答 解:反应结束后测得产生气体质量为0.5g.用电火花引爆气体.冷却后剩余氧气质量为0.32g,则氢气的质量为(0.5g-0.32g)×$\frac{2}{18}$=0.02g,与水反应生成氧气的质量为0.5g-0.02g=0.48g,生成的溶液用含HCl 3.65g稀盐酸恰好中和,n(HCl)=$\frac{3.65g}{36.5g/mol}$=0.1mol,则反应后溶液中n(Na+)=0.1mol,
(1)由Na原子守恒可知,原来金属钠的质量为0.1mol×23g/mol=2.3g,
答:原来金属钠的质量为2.3g;
(2)设A中Na的质量为x,过氧化钠的质量为y,
由2Na+2H2O=2NaOH+H2↑
46 2
x 0.02g,
x=$\frac{46×0.02g}{2}$=0.46g,其物质的量为0.02mol,
2Na2O2+2H2O=4NaOH+O2↑
156 32
y 0.48g
y=$\frac{156×0.48g}{32}$=2.34g,其物质的量为$\frac{2.34g}{78g/mol}$=0.03mol,
由钠原子守恒可知,0.02mol+0.03mol×2<0.1mol,
则含Na2O为$\frac{0.1mol-0.02mol-0.03mol×2}{2}$×62g/mol=0.62g,
答:固体A中各组分的质量为0.46gNa、2.34gNa2O2、0.62gNa2O.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,注意原子守恒的应用,侧重分析与计算能力的考查,题目难度不大.

| A. | l种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 5 克 H2 | B. | 24 克HCl | C. | 48克SO2 | D. | 55克CO2 |
| A. | 王安石的《元日》:“爆竹声中一岁除,春风送暖入屠苏” | |
| B. | 刘禹锡的《浪淘沙》:“美人首饰侯王印,尽是江中浪底来” | |
| C. | 刘琨的《重赠卢谌》:“何意百炼钢,化为绕指柔” | |
| D. | 李商隐的《无题》:“春蚕到死丝方尽,蜡炬成灰泪始干” |
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 恒温下加入少量CaO,溶液的pH增大 | |
| D. | 降低温度,溶液中c(OH-)增大 |
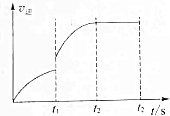 将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )
将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )| A. | 升温 | B. | 使用催化剂 | C. | 加入一定量NH3 | D. | 加入一定量N2 |
| A. |  NaHSO3 粉末加入HNO3溶液中 | B. |  SO2气体通入H2S溶液中 | ||
| C. |  NaOH溶液滴入Ca(HCO3)2溶液中 | D. |  CO2气体通入NaOH溶液中 |
 A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题:
A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题: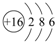 .
.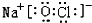 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.