题目内容
13.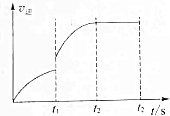 将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )
将N2,H2按物质的量比为1:3的比例混合于5L的恒容密闭容器中进行反应N2+3H2?2NH3,△H<0,若该反应的逆反应速率随时间变化的关系如图所示.则t1时改变的条件不可能是( )| A. | 升温 | B. | 使用催化剂 | C. | 加入一定量NH3 | D. | 加入一定量N2 |
分析 根据图知,t1时逆反应速率离开原速率增大,且随着反应的进行,逆反应速率逐渐增大,说明平衡向逆反应方向移动,据此分析解答.
解答 解:A、根据图知,t1时逆反应速率瞬间增大,且随着反应的进行,正反应速率逐渐增大,说明平衡向逆反应方向移动,可以是升高温度,故A正确;
B、使用催化剂,正逆反应速率加快,但是化学平衡状态不变,不符合图示,故B错误;
C、加入一定量的氨气,逆反应速率迅速增加,化学反应速率加快,平衡逆向移动,符合图示,故C正确;
D、加入一定量的氮气,正反应速率迅速增加,但是逆反应速率不会离开原来的速率点,不符合图中信息,故D错误.
故选BD.
点评 本题考查化学平衡图象分析,明确图中反应速率与物质浓度关系是解本题关键,会根据图象曲线变化确定反应方向,题目难度中等.

练习册系列答案
相关题目
3.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
| A. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol | |
| B. | 参加反应的金属的总质量 3.6g<m<9.6 g | |
| C. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL | |
| D. | 当金属全部溶解时收集到NO气体的体积在标况下为 2.24L |
7.下列关于FeCl2、FeCl3溶液和Fe(OH)3胶体的说法,错误的是( )
| A. | 三种分散系中分散质微粒都带电荷 | |
| B. | 加热蒸干并灼烧,得到的产物都是三氧化二铁 | |
| C. | FeCl2、FeCl3、溶液能稳定存在,而Fe(OH)3胶体不能稳定存在 | |
| D. | 一定条件下可完成转化:FeCl2溶液→FeCl3溶液→Fe(OH)3胶体 |
 如图为某浓盐酸试剂瓶标签上的部分数据.请列式计算回答下列问题:
如图为某浓盐酸试剂瓶标签上的部分数据.请列式计算回答下列问题: