题目内容
【题目】(1)在常温下,发生下列几种反应:
①16H++10Z﹣+2XO4﹣═2X2++5Z2+8H2O
②2A2++B2═2A3++2B﹣③2B﹣+Z2═B2+2Z﹣
根据上述反应,XO4﹣、Z2、B2、A3+氧化性从强到弱的顺序为:
(2)已知KMnO4 与浓盐酸发生如下反应:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
在上述反应中,氧化产物和还原产物物质的量之比是 .用单线桥法标出此反应的电子转移方向和数目 .
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子.请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个配平的化学方程式:
+ +H2SO4→ + + (填化学式)
②反应中1mol氧化剂得到 mol电子.
【答案】XO4﹣>Z2>B2>A3+;5:2;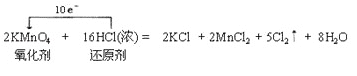 ;5K2SO3;2KIO3;I2;6K2SO4;H2O;5
;5K2SO3;2KIO3;I2;6K2SO4;H2O;5
【解析】(1)氧化剂的氧化性大于氧化产物的氧化性,
①16H++10Z﹣+2XO4﹣═2X2++5Z2+8H2O,氧化性:XO4﹣>Z2 ,
②2A2++B2═2A3++2B﹣ , 氧化性:B2>A3+ ,
③2B﹣+Z2═B2+2Z﹣ , 氧化性:Z2>B2 ,
所以氧化性关系为:XO4﹣>Z2>B2>A3+ ,
所以答案是:XO4﹣>Z2>B2>A3+;
(2)该反应中Mn由+7变为+2,MnCl2是还原产物,Cl由﹣1变为0,Cl2是氧化产物,因此氧化产物和还原产物物质的量之比是5:2,转移电子数目为2×(7﹣2)=10×[0﹣(﹣1)]=10,用单线桥表示反应中电子转移的方向和数目为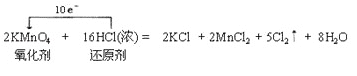 ,
,
所以答案是:5:2;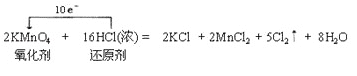 ;
;
(3)①在反应中K2SO3失去电子,则氧化反应为K2SO3→K2SO4 , 在给出的物质中只有碘元素的化合价降低符合,则还原反应为KIO3→I2 , 由质量守恒定律可知,该反应在酸性条件下进行,则水为生成物,即反应物为K2SO3、H2SO4、KIO3 , 生成物为K2SO4、I2、H2O,化学方程式为5K2SO3+2 KIO3+H2SO4═I2+6K2SO4+H2O,
所以答案是:5K2SO3;2KIO3;H2SO4;I2;6K2SO4;H2O;
②该反应中碘元素的化合价降低,则氧化剂为KIO3 , 1mol氧化剂得到电子为1mol×(5﹣0)=5mol,
所以答案是:5.
【考点精析】本题主要考查了氧化性、还原性强弱的比较的相关知识点,需要掌握金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强才能正确解答此题.

