题目内容
【题目】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
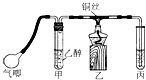
步骤一:废铜屑制硝酸铜
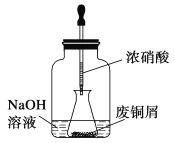
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________。
(2)上图装置中NaOH溶液的作用是_________________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式:__________________;
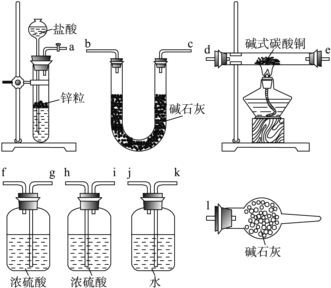
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________(填“可行”或“不可行”)请说明理由________________________。
【答案】 Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O 吸收氮氧化物 烧杯 温度计 受热均匀,便于控制温度 xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O kj→gf(hi)→de(ed)→hi(gf)→bc(cb) 1.8 CuCO3Cu(OH)2H2O 可行 根据反应xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
===Cu2++2NO2↑+2H2O 吸收氮氧化物 烧杯 温度计 受热均匀,便于控制温度 xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O kj→gf(hi)→de(ed)→hi(gf)→bc(cb) 1.8 CuCO3Cu(OH)2H2O 可行 根据反应xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
【解析】(1) 浓硝酸与铜反应生成硝酸铜、二氧化氮和水,离子方程式:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O;正确答案:Cu+4H++2NO
===Cu2++2NO2↑+2H2O;正确答案:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O。
===Cu2++2NO2↑+2H2O。
(2)由于反应产生的氮氧化物有毒,必须处理掉,用NaOH溶液吸收氮氧化物;正确答案:吸收氮氧化物。
(3)步骤二中,水浴加热所需仪器有烧杯、温度计;水浴加热的优点是受热均匀,便于控制温度;正确答案:烧杯、温度计;受热均匀,便于控制温度。
(4)①![]() 与氢气反应生成单质铜、水、二氧化碳,反应式为:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;正确答案:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O。
与氢气反应生成单质铜、水、二氧化碳,反应式为:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;正确答案:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O。
②实验中要测定生成的水、二氧化碳的量,从a口出来气体中含有水蒸气和挥发出来的氯化氢气体,会对实验造成干扰,应先用用水吸收氯化氢气体,再用浓硫酸吸收水蒸气;之后,与碱式碳酸铜发生反应,产生的两种气体先用浓硫酸吸收水蒸气,再用U型管中的碱石灰吸收二氧化碳,同时连上装有碱石灰的球形干燥管,避免空气中的水和二氧化碳进入U型管而产生误差,因此装置的连接顺序为a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l;正确答案:kj→gf(hi)→de(ed)→hi(gf)→bc(cb)。
③根据题中所给数据可计算出单质铜、水、二氧化碳的物质的量为0.2mol、0.4mol、0.1mol,因此可知![]() ,则x、y、z分别为1、1、1,该样品的化学式为
,则x、y、z分别为1、1、1,该样品的化学式为![]() ,结晶水的质量为
,结晶水的质量为![]() ;正确答案:1.8 ; CuCO3Cu(OH)2H2O。
;正确答案:1.8 ; CuCO3Cu(OH)2H2O。
④ 根据反应xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成,该方案可行;正确答案:可行;根据反应xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。玉溪一中化学兴趣小组在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为____________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中____________ | ②反应的化学方程式______,该反应中被氧化和被还原的氮元素的质量比是____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③____________ | ④______________ |