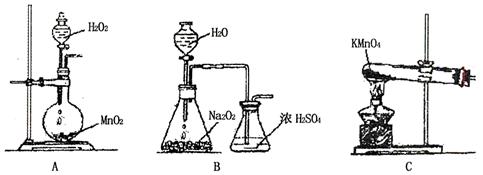
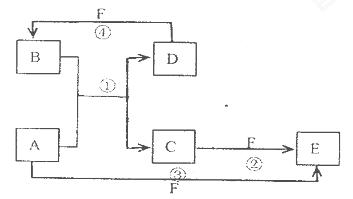
��Ŀ����
A��B��C��D������ѧ��ѧ���������ʣ�����A��B��C������ͬһ��Ԫ�ء���һ���������ת���Ĺ�ϵ��ͼ��ʾ(���ַ�Ӧ�е�H2O����ȥ)���밴Ҫ��ش��������⣺
��1����DΪ�������ʣ���D�����������;���Ľ���������������B����Һû�еõ�B���Σ���B�Ļ�ѧʽ����Ϊ__________________________��
��2����A�������������B��DΪ��������Ҫ�ɷ֣���Ӧ(��) �Ļ�ѧ����ʽΪ______________��
��3����DΪ�ȼҵ����Ҫ��Ʒ����Ӧ(��)�����ӷ���ʽ������_________________________��
��4����DΪ����������壬��A��B��C��D������________________(�밴˳��д�������Ĵ�)��
��1��FeCl3��Fe(NO3)3
��2��4NH3+6NO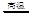 5N2+6H2O
5N2+6H2O
��3��Al3++3AlO2-+6H2O====4Al(OH)3��
��4��NaOH��Na2CO3��NaHCO3��CO2(��NaOH��Na2SO3��NaHSO3��SO2)(������������)
���������������1����������֪��D�����������;���Ľ�������DΪ�����ʣ����б�ۣ�������Ԫ�ص�B������Ӧ����C��˵��B����Ԫ��Ϊ��3�ۣ�C����Ԫ��Ϊ��2�ۣ�A��������Ϊ��3�ۣ�ͬʱAҲ�ܽ�����2������C����Ϊ��3�ۣ���������B����Һû�еõ�B���Σ�˵�����ζ�Ӧ����Ϊ�ӷ����ᣬ����ƶ�AΪ����(��HNO3)��BΪ�Ȼ����ۻ�Fe(NO3)3�ݣ�CΪ�Ȼ������ۻ�Fe(NO3)2�ݣ���2����A�������������A�ǰ�����B��DΪ��������Ҫ�ɷ֣�D��������B�ǵ�����CΪNO����Ӧ(��)Ϊ������һ��������Ӧ���ɵ�����ˮ����ѧ����ʽΪ4NH3+6NO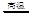 5N2+6H2O����3����DΪ�ȼҵ����Ҫ��Ʒ����DӦΪNaOH��������ת����ϵ֪��AΪ���������Σ�BΪ��������������CΪƫ�����Σ���Ӧ�������ӷ���ʽΪAl3++3AlO2-+6H2O=4Al��OH��3������4����DΪ����������壬A�����������巴Ӧ�������ֲ�ͬ�Ļ������A��B��C��D����NaOH��Na2CO3��NaHCO3��CO2��NaOH��Na2SO3��NaHSO3��SO2��Fe��Fe��NO3��2��Fe��NO3��3��HNO3��
5N2+6H2O����3����DΪ�ȼҵ����Ҫ��Ʒ����DӦΪNaOH��������ת����ϵ֪��AΪ���������Σ�BΪ��������������CΪƫ�����Σ���Ӧ�������ӷ���ʽΪAl3++3AlO2-+6H2O=4Al��OH��3������4����DΪ����������壬A�����������巴Ӧ�������ֲ�ͬ�Ļ������A��B��C��D����NaOH��Na2CO3��NaHCO3��CO2��NaOH��Na2SO3��NaHSO3��SO2��Fe��Fe��NO3��2��Fe��NO3��3��HNO3��
���㣺���������ƶϡ�Ԫ�ػ�����֪ʶ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���ȡ�������ۣ���һ���м������������ᣬ�ڶ����м����������ռ��ͬ��ͬѹ�·ų���ͬ��������壬���������۵�������Ϊ
| A��2��3 | B��1��6 | C��3��2 | D��1��1 |
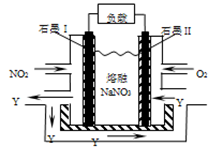
���������ǡ�DZͧ�ϵĺ˷�Ӧ����ʹ����Һ�����ƺϽ�(�����ƺ͵������ۺ϶���)�����Ƚ��ʣ��й�˵������ȷ����
| A���Ͻ���۵�һ�����ֽ����� |
| B�����ƺϽ���Ͷ��һ������ˮ�пɵ���ɫ��Һ����n(Al)��n(Na) |
| C�����ƺϽ�Ͷ�뵽�����Ȼ�ͭ��Һ�У�����������ͭ����Ҳ������ͭ���� |
| D����m g��ͬ��ɵ����ƺϽ�Ͷ�����������У��ų���H2Խ�࣬��������������ԽС |
��16�֣�ijУ����ͬѧ�߿�ǰ�������������α�ʵ�飬����ش�ʵ������е�������⣺
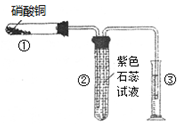
��1�����ȷ�Ӧʵ�飺ȡ�����������۰��α��е�ʵ��װ�ã���ͼ���������ȷ�Ӧ������Ӧ
�����á����顱�������ᣬ��Ӧ�����Һ�еμ�KSCN��Һ��������Һ��Ѫ��ɫ��
�ٳ������������ԭ���������顱�п��ܻ���û��Ӧ���
�����������⣬����һ�ֿ���ԭ������ ��
�� ��Ҫ֤����Ӧ���á����顱�к��н����������� ���ѧʽ����Һ����������Ӧ�����ӷ���ʽΪ�� ��
��2����ѧ��Ӧ����Ӱ�����ص�̽��ʵ�飺
KI�ھ��ữ����Һ�б����������ķ�ӦʽΪ��4H+ + 4I-+ O2 = 2I2 + 2H2O���÷�Ӧ���������¶ȡ���ȡ��ܼ����Լ�Ũ�ȵ�Ӱ�죬���õ���������ɫ��Ӧ���۲�÷�Ӧ�����ʡ���֪������������ɫ��Ӧ���¶�����ʱ�����Ȼή�ͣ�����75��������ɫ������Ũ��Խ����ɫԽ��������ɫҲԽ�
ʵ��С������0.8 mol��L-1 KI��Һ��0.1 mol��L-1H2SO4��Һ��������Һ����̽���¶ȡ���ȶ�������Ӧ���ʵ�Ӱ�죬��������A��C����ʵ�飬����ʵ���������±���
| ��� | �¶�/�� | H2SO4���/mL | KI��Һ���/mL | H2O���/mL | ������Һ / mL | ������ɫʱ�� /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | û������ɫ |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | | | | | | t |
��A��C����ʵ��ʱ����������5mLˮ����Ŀ���� ��
��B��ʵ���С�û������ɫ����ԭ���� ��
������ΪС�����D��ʵ�鷽�����ڱ���հ״���������Ƶ�5�����ݣ�������С�����̽��Ŀ�ꡣ
�ݰ�����Ƶ�ʵ�����ݣ�����Ԥ��һ��tֵ����д������Ԥ�����Ӧ��̽��ʵ���
�� ��
�����13�֣��ס�����ͬѧ�о�Na2SO3��Һ��FeCl3��Һ��Ӧ�������
| ���� | ���� | ���� |
| �� | ��2mL 1 mol��L-1FeCl3��Һ�м���һ������Na2SO3��Һ | ��Һ���ػ�ɫ��Ϊ���ɫ�����������̼�����ζ�������ݳ� |
��2���������ɫ������ԭ��
�� ��ͬѧ��Ϊ����I����Һ�ʺ��ɫ����Ϊ������Fe(OH)3�����û�ѧƽ���ƶ�ԭ��������Һ�ʺ��ɫ��ԭ��________��
�� ��ͬѧ��Ϊ�����Ƿ�����������ԭ��Ӧ������Fe3+ ��Fe2+ ����д��Fe3+ ��SO32����Ӧ�����ӷ���ʽ
______________��
��ͬѧ�������ϵ�֪��
1��Fe2+��SO32����Ӧ����ī��ɫ����״����FeSO3��
2��ī��ɫ��FeSO3���ɫ��FeCl3��Һ��Ϻ���Һ�ʺ��ɫ��
��3����ͬѧΪ��ȷ����Һ�ʺ��ɫ��ԭ����������Fe(OH)3����Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| �� | �ü�������䲽��I�еĺ��ɫ��Һ | ���֡������ЧӦ�� |
��4��Ϊ��һ��ȷ��Na2SO3��Һ��FeCl3��Һ��Ӧ���������ͬѧ��Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| �� | ��1 mol?L-1��FeCl3��Һ��ͨ��һ������SO2 | ��Һ�ɻ�ɫ��Ϊ���ɫ |
| �� | �ü�������䲽����еĺ��ɫ��Һ | û�г��֡������ЧӦ�� |
a��K3[Fe(CN)6] ��Һ b��KSCN��Һ c��KMnO4��Һ
�� �������ӷ���ʽ�ͱ�Ҫ������˵��������г��ֺ��ɫ��ԭ�� ��
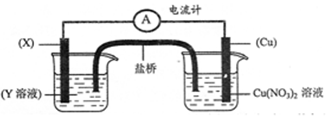
��5�����ۣ�������ʵ���֪���ס�����ͬѧ���ֹ۵����ȷ��
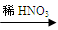 Cu(NO3)2 �ң�Cu
Cu(NO3)2 �ң�Cu 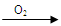 CuO
CuO