题目内容
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu 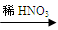 Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu 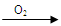 CuO
CuO 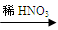 Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。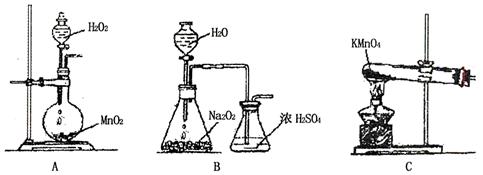
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g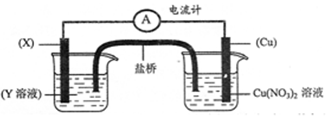
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;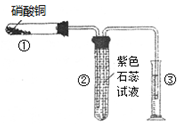
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。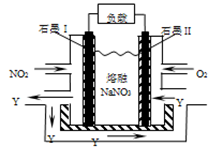
① 乙 (2分) 100 (1分) ② B (1分)
③ c (2分)
(2)① 2Cu(NO3)2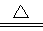 CuO+4NO2↑+O2↑ (2分,条件不写扣1分,未配平扣1分)
CuO+4NO2↑+O2↑ (2分,条件不写扣1分,未配平扣1分)
② NO2气体会腐蚀橡胶 (2分) [来源:学科网]
(3) NO2+NO3--e-=N2O5 (2分,未配平扣1分)
解析试题分析:铜与硝酸直接反应会产生二氧化氮气体,会污染环境,所以选乙装置,列出方程式,即可知道用乙可节约100ml.B装置容易控制反应的起始和终止,因此应该选择B装置。铜有可能做正极也有可能做负极所以铜电极可能增重64g,也可能减重64g。Cu(NO3)2受热分解的化学方程式2Cu(NO3)2 CuO+4NO2↑+O2↑,在装置中①试管的橡皮塞最好用锡箔包住,原因是NO2气体会腐蚀橡胶。在燃料电池中,燃料做负极,氧气做正极。所以电极反应式为NO2+NO3--e-=N2O5
CuO+4NO2↑+O2↑,在装置中①试管的橡皮塞最好用锡箔包住,原因是NO2气体会腐蚀橡胶。在燃料电池中,燃料做负极,氧气做正极。所以电极反应式为NO2+NO3--e-=N2O5
考点:考查实验的基本装置以及原电池的相关知识点

 阅读快车系列答案
阅读快车系列答案下列关于铝及其化合物的说法不正确的是
| A.Al既可用于食品包装,也可用做建筑材料 |
| B.Al2O3既可用来冶炼金属Al,也可用做耐火材料 |
| C.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂 |
| D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐 |
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O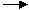 Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O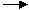 W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
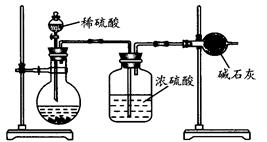
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。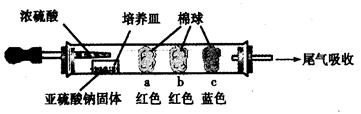
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
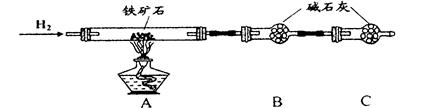
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
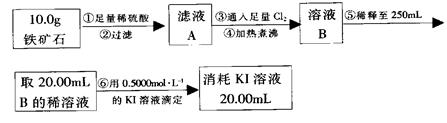
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
A.滴定管用蒸馏水洗涤后再用待装液润洗
B.锥形瓶需要用待测液润洗
C.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为