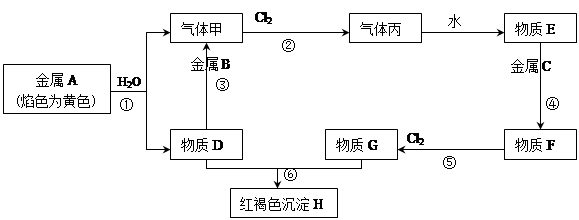题目内容
(1)
(2)CaFeC2O6(或CaCO3·FeCO3);CaCO3·FeCO3△CaO+FeO+2CO2↑。
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)3FeO+CO2===Fe3O4+CO检验方法:Fe2O3:将固体加入盐酸溶解,再滴入KSCN溶液,溶液呈血红色;CuO:将固体加入盐酸溶解,再滴入氨水溶液,溶液出现蓝色沉淀,继续加入氨水,沉淀溶解,生成深蓝色溶液。
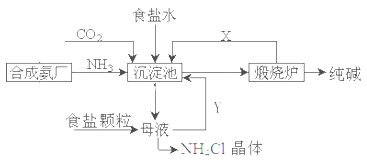
解析试题分析:白色沉淀2在空气中变成红褐色沉淀说明白色沉淀2是Fe(OH)2。溶液1中通入甲气体,有白色沉淀1,再通入甲气体(注意:水存在时)又溶解,甲气体是弱酸性气体,根据X与固体1的质量确定是CO2。
考点:物质之间的转化推断与物质的鉴别。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
小明在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是
| A.分解反应 | B.复分解反应 |
| C.化合反应 | D.置换反应 |
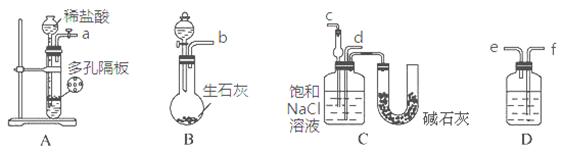
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。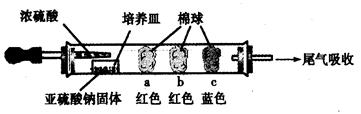
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
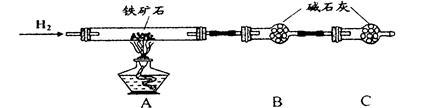
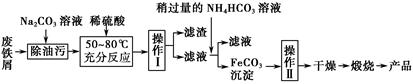
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定

(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
A.滴定管用蒸馏水洗涤后再用待装液润洗
B.锥形瓶需要用待测液润洗
C.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为