题目内容
【题目】(1)已知:H2(g)+1/2O2(g)H2O(g),反应过程中能量变化如图所示,则:
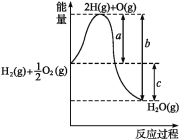
①a、b、c分别代表什么意义?
a______________________________;
b_______________________________;
c_______________________________。
②该反应是ΔH____________0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,已知:H2(g)+![]() O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式____________________________________________
【答案】1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量 H、O结合生成1 mol H2O(g)放出的热量 1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量 < H2(l)+![]() O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
【解析】
可逆反应能量变化图像中,a是反应活化能,b是产物化学键结合释放的能量,c为反应热;根据盖斯定律,液氢和液氧生成气态水ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4。
①
a——反应活化能,指1 mol H2分裂为H,0.5 mol O2分裂为O时吸收的热量;
b——H、O结合生成1 mol H2O(g)放出的热量;
c——反应热,指1 mol H2和0.5 mol O2生成1 mol H2O(g)时反应放出的热量。
②该图可知,ΔH=生成物总能量-反应物总能量<0,反应放热。
(2) 设H2(g)+![]() O2(g)H2O(l) ΔH1=-285.8 kJ·mol-1;
O2(g)H2O(l) ΔH1=-285.8 kJ·mol-1;
H2(g)H2(l) ΔH2=-0.92 kJ·mol-1;
O2(g)O2(l) ΔH3=-6.84 kJ·mol-1;
H2O(l)H2O(g) ΔH4=+44.0 kJ·mol-1,液氢和液氧生成气态水的化学方程式为H2(l)+![]() O2(l)H2O(g),ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4=-237.46 kJ·mol-1。
O2(l)H2O(g),ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4=-237.46 kJ·mol-1。

【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。

Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |