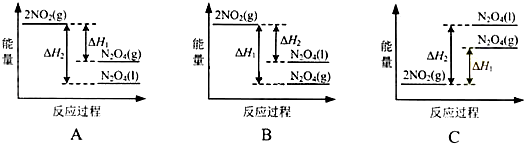
题目内容
9.在容积为2L的密闭容器中充入3mol气体A和2.5mol气体B,发生反应:3A(g)+B(g)?xC(g)+2D(g)(正反应为吸热反应),5min时测得生成1mol D,C的平均反应速率v(C)=0.1mol•L-1•min-1,试求:(1)方程式中C的化学计量数x=2.
(2)5min内A的平均反应速率v(A)=0.15mol/L•min.
(3)5min时B的转化率为20%.
(4)温度升高A的转化率增大(填“增大”或“减小”或“不变”下同),压强增大B的转化率不变.
分析 结合化学平衡三段式列式计算,C的平均反应速率v(C)=0.1mol•L-1•min-1,反应生成C物质的量=0.1mol•L-1•min-1×2L×5min=1mol;
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol) 3 2.5 0 0
变化量(mol) 1.5 0.5 0.5x 1
平衡量(mol) 1.5 2 0.5x 1
(1)依据上述计算结合反应生成的C物质的量计算得到x;
(2)反应速率=$\frac{△c}{△t}$;
(3)转化率=$\frac{消耗量}{起始量}$×100%;
(4)由题意可知,正反应为吸热反应,所以升高温度,平衡向正反应方向移动,由(1)计算得x,根据增大压强,平衡向气体体积减小的方向移动进行判断.
解答 解:C的平均反应速率v(C)=0.1mol•L-1•min-1,反应生成C物质的量=0.1mol•L-1•min-1×2L×5min=1mol;
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol) 3 2.5 0 0
变化量(mol) 1.5 0.5 0.5x 1
平衡量(mol) 1.5 2 0.5x 1
(1)上述计算结合反应生成的C物质的量计算得到x,0.5x=1,x=2;
故答案为:2;
(2)5min内A的平均反应速率=$\frac{△c}{△t}$=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/L•min;
故答案为:0.15mol/L•min;
(3)5min时B的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.5mol}{2.5mol}$×100%=20%;
故答案为:20%;
(4)由题意可知,正反应为吸热反应,所以升高温度,平衡向正反应方向移动,所以A的转化率增大,由(1)计算得x=2,所以该反应为气体体积不变的反应,增大压强,平衡不移动,所以B的转化率不变,
故答案为:增大;不变.
点评 本题考查了化学平衡计算应用,主要是反应速率、转化率的计算应用、影响平衡移动的因素等,概念理解应用是解题关键,题目较简单.

| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
| A. | 常温常压下,5.6 L一氧化碳和5.6 L氧气混合后的分子总数为0.5NA | |
| B. | 标准状况下,5.6 L N2和16.8L NO混合气体中的原子数为2NA | |
| C. | 标准状况下,22.4L H2O中分子数为NA | |
| D. | 常温常压下,1 mol氦气含有的原子数为2NA |
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 200mL 0.5mol•L-1 HCl溶液 |