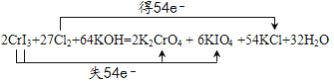
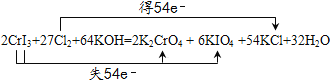
题目内容
【题目】下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
【答案】B
【解析】A.电离出的阳离子全部是氢离子的为酸,电离出的阴离子全部是氢氧根离子的为碱,由金属阳离子或铵根离子和酸根离子构成的为盐,由两种元素组成,其中一种元素是氧元素的为氧化物,纯碱为盐不是碱,A项错误;B.在水溶液里和熔融状态下都不导电的化合物是非电解质,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,蔗糖在水溶液里或熔融状态下以分子存在,所以为非电解质,硫酸钠在熔融状态下或水溶液里完全电离,为强电解质,水为弱电解质,B项正确;C.点燃条件下,镁条在二氧化碳中燃烧生成氧化镁和碳,反应方程式为:CO2+2Mg![]() 2MgO+C,C项错误;D.在加热条件下,浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体小于2.24L, D项错误;答案选B。
2MgO+C,C项错误;D.在加热条件下,浓硫酸和铜发生氧化还原反应,但稀硫酸和铜不反应,所以含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体小于2.24L, D项错误;答案选B。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
【题目】已知反应A(s)+B(g)C(g)+D(g)的化学平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是( )
A.该反应为吸热反应
B.该反应的化学平衡常数表达式为K= ![]()
C.其他条件不变时,增大体系的压强,化学平衡常数减小
D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态