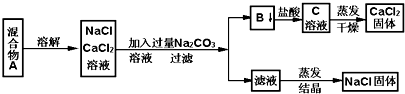
题目内容
4.石灰氮(有效成分为CaCN2)既是一种用途广泛的化工原料,又可用作肥料和绿色农药.生产原理为CaC2(s)+N2(g)═CaCN2(s)+C(s)△H=-3010kJ•mol-1,工艺流程如下: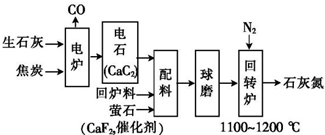
(1)电炉中发生反应的化学方程式为CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑.
(2)生产中必须控制湿度,电石遇湿会产生C2H2、H2S、PH3等气体,说明电石中含有CaS、、Ca3P2等杂质(写化学式).
(3)以10吨CaO质量分数为96%的生石灰为原料,理论上最多可制得含CaCN2 24%的石灰氮产品57.14吨.
(4)回炉料是淘汰的不合格产品返回到生产线上作为原材料来使用,该工艺中使用回炉料的优点是提高资源的利用率.
(5)相同原料、相同配料比,某次得到的石灰氮产品中含氮量较低,可能的原因是(任写一点)回转炉中的温度过高.
(6)石灰氮用作化肥时,适合于酸性土壤,石灰氮长时间露置空气中会生成一种盐和一种碱性气体,该反应的化学方程式为CaCN2+3H2O=CaCO3+2NH3↑.
分析 (1)电炉中发生反应的反应物为生石灰和碳,生成物为一氧化碳和电石,据此写化学方程式;
(2)根据元素守恒和水解的原理判断电石中含有杂质;
(3)根据钙元素守恒,10吨CaO质量分数为96%的生石灰中钙的物质的量为$\frac{10×1{0}^{6}×0.96}{56}$mol=1.71×105mol,理论上最多可制得含CaCN2 的物质的量为1.71×105mol,据此计算石灰氮的产量;
(4)使用回炉料可以提高资源的利用率;
(5)如果原料、配料比都相同的情况下,某次得到的石灰氮产品中含氮量较低,可从反应控制的条件分析;
(6)石灰氮水解会生成一种盐和一种碱性气体,则这种盐应为碳酸钙,碱性气体应为氨气,碱性气体会使土壤呈碱性,据此答题;
解答 解:(1)电炉中发生反应的反应物为生石灰和碳,生成物为一氧化碳和电石,反应化学方程式为CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,
故答案为:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑;
(2)根据元素守恒和水解的原理可知电石中应含有杂质为钙的硫化物和钙的磷化物,即CaS、Ca3P2,
故答案为:CaS、Ca3P2;
(3)根据钙元素守恒,10吨CaO质量分数为96%的生石灰中钙的物质的量为$\frac{10×1{0}^{6}×0.96}{56}$mol=1.71×105mol,理论上最多可制得含CaCN2 的物质的量为1.71×105mol,所以生成含CaCN2 24%的石灰氮的质量为1.71×105×80g÷24%=57.14×106g=57.14吨,
故答案为:57.14;
(4)根据元素守恒,使用回炉料可以提高资源的利用率,
故答案为:提高资源的利用率;
(5)如果原料、配料比都相同的情况下,由于生成石灰氮的反应为放热反应,所以某次得到的石灰氮产品中含氮量较低,可能的原因是回转炉中的温度过高,不利于反应生成石灰氮,
故答案为:回转炉中的温度过高;
(6)石灰氮水解会生成一种盐和一种碱性气体,则这种盐应为碳酸钙,碱性气体应为氨气,反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,碱性气体会使土壤呈碱性,所以石灰氮用作化肥时,适合于酸性土壤,
故答案为:酸;CaCN2+3H2O=CaCO3+2NH3↑.
点评 本题考查石灰氮的制备,涉及工业流程分析、化学方程式的书写、化学计算等,较为综合,难度较大,弄清实验原理是解题的关键.

 阅读快车系列答案
阅读快车系列答案(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
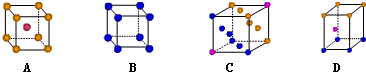
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.
(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
| A. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| B. | 以CO和O2构成的碱性燃料电池负极反应式为CO+4OH--2e-═CO32-+2H2O | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Z>W | |
| C. | 单质的沸点:Z>W>X | |
| D. | X分别与Y、Z、W形成的化合物的化学键类型相同 |
| A. | 5.4g | B. | 3.6g | C. | 2.7g | D. | 1.8g |
| A. | 合成塔的燃烧器内中心管道内通入氢气 | |
| B. | 应当控制氯气的用量少于氢气 | |
| C. | 氯气在氢气中燃烧,火焰为蓝色 | |
| D. | 反应需要点火才能进行,因此是一个吸热反应 |
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 所有的有机物都很容易燃烧; | |
| D. | CH3CH2CH2CH2Cl的沸点比CH3CH2CH2CH2Br的沸点低 |
| A. | NaA溶液中水的电离程度比NaB溶液中水的电离程度大 | |
| B. | 在NaA溶液中:c(Na+)-c(A-)=10-8mol•L-1 | |
| C. | 将两溶液等体积混合,混合溶液的pH约为10 | |
| D. | 在NaB溶液中:c(H+)+c(HB)=10-2mol•L-1 |