题目内容
20.能用于鉴别淀粉、肥皂和蛋白质三种溶液的试剂是( )| A. | 碘水 | B. | 烧碱溶液 | C. | 浓硝酸 | D. | Na2SO4溶液 |
分析 淀粉遇碘变蓝色,肥皂的成分是硬脂酸钠,能和强酸发生生成硬脂酸沉淀,蛋白质能发生盐析、变性、颜色反应,据此分析解答.
解答 解:A.淀粉碘遇变蓝色,可鉴别淀粉,但和肥皂、蛋白质不反应,所以无法鉴别这三种物质,故A错误;
B.氢氧化钠溶液能使蛋白质变性,和淀粉、肥皂不反应,不能鉴别,故B错误;
C.用浓硝酸鉴别,分别取样,在样品中加入适量浓硝酸,变黄的是蛋白质溶液(黄蛋白反应),无明显变化的是淀粉,硬脂酸钠能和强酸发生生成硬脂酸,硬脂酸不溶于水,所以有固体析出的是肥皂水,所以浓硝酸能鉴别这三种物质,故C正确;
D.硫酸镁能使蛋白质产生盐析,但和淀粉、肥皂不反应,故D错误;
故选C.
点评 本题考查有机物鉴别,为高频考点,明确物质性质差异性是解本题关键,侧重于学生的分析能力和实验能力的考查,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
10.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物 | |
| B. | 乙烷(乙烯):通过盛有足量酸性KMnO4溶液的洗气瓶洗气 | |
| C. | CCl4(乙醇):多次加水,振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
11.将V1 L的H2和V2 L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为V3 L(气体体积均在恒温恒容条件下测定),则生成NH3的体积是( )
| A. | (V1+V2+V3)L | B. | (V1+V2-V3)L | C. | (V1+V2-2V3)L | D. | V3-(V1+V2)L |
8.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molCl2与一定量的Fe刚好完全反应电子转移数为3NA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 在 H2O2+Cl2═2HCl+O2反应中,每生成NA个O2分子,消耗的Cl2的体积是22.4L | |
| D. | 将10mL5mol•L-1的FeCl3溶液滴入沸水中得到Fe(OH)3胶体,其胶粒数为0.05NA |
15.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.
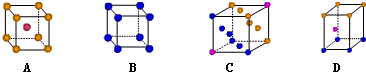
(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
(一)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
Na、Mg、Al第一电离能I从小到大的排列顺序是Na、Al、Mg.
(二)(1)写出基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;位于元素周期表的ds区,金属铜采用下列C(填字母代号)堆积方式.

(2)氮及其化合物在生活、生产和科技等方面有重要的应用.请回答下列问题:
①在氮气分子中,氮原子之间存在着1个σ键和2个π键;
②用氢键表示式写出氮的氢化物溶液中存在的所有氢键O-H…N、N-H…O、O-H…O、N-H…N.
5.下列离子方程式正确的是( )
| A. | 苯酚与碳酸氢钠溶液反应:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O | |
| B. | 溴乙烷转化成乙醇:C2H5Br+OH- $→_{△}^{水}$C2H5OH+Br- | |
| C. | 肥皂液加入醋酸:C17H35COO-+H+→C17H35COOH | |
| D. | 甲醛溶液与足量的新制Cu(OH)2共热:HCHO+2Cu(OH)2+OH-$\stackrel{△}{→}$HCOO-+Cu2O↓+3H2O |
12.下列有关说法正确的是( )
| A. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| B. | 以CO和O2构成的碱性燃料电池负极反应式为CO+4OH--2e-═CO32-+2H2O | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | 工业上通过电解氯化钠溶液制备金属钠和氯气 |
9.甲乙两烧杯中各盛有300mL 1mol/L盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉.反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉质量为( )
| A. | 5.4g | B. | 3.6g | C. | 2.7g | D. | 1.8g |
10.下列关于物质性质或检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过湿润的蓝色石蕊试纸,试纸变红,证明原气体中含有氨气 | |
| C. | 用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,可能有K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |