题目内容
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为
Ⅳ.C(s)+O2(g)===CO2;
Ⅴ.CaCO3(s)===CaO(s)+CO2(g)。
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”或“不变”),再补充a mol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为__________。
(3)已知反应Ⅱ的ΔH=-41.1 kJ/mol,C≡O 、O—H、H—H键的键能分别为1072.9 kJ/mol,464 kJ/mol、436 kJ/mol,则C=O的键能为________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡________移动(填“向右”、“向左”或“不”);当重新平衡后,CO2浓度________(填“变大”、“变小”或“不变”)。
【答案】 K1·K2·K3 25% 不变 1:a 803 正向 不变
【解析】(1)根据盖斯定律分析,反应为反应Ⅰ+反应Ⅱ+反应Ⅲ,所以平衡常数K= K1·K2·K3,故答案为: K1·K2·K3 ;(2). 假设水蒸气的消耗的物质的量为xmol,则有
C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
起始物质的量1 1 0 0
改变的物质的量x x x x
平衡时物质的量 1-x 1-x x x
根据信息有恒温恒压条件下体积比等于气体总物质的量比,即(1-x+x+x)/1=1.25,解x=0.25mol,则水蒸气的转化率=0.25/1=25%,向体系中加入碳,因为碳为固体,不影响平衡,再补充a mol水蒸气(H218O),则平衡正向移动,因为反应物中16O和18O的比例为1:a,则生成物中二者的比例也为1:a,所以最终容器中C16O和C18O的物质的量之比1:a,故答案为:25%;不变;1:a;(3).根据反应热=反应物的键能总和-生成物的键能总和分析,有-41.1=1072.9+464×2-x-436,解x=803 kJ/mol,,故答案为:803; (4). 对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡正向移动,因为温度不变 ,平衡常数不变,所以平衡时二氧化碳的浓度不变,故答案为:正向;不变。

 暑假作业暑假快乐练西安出版社系列答案
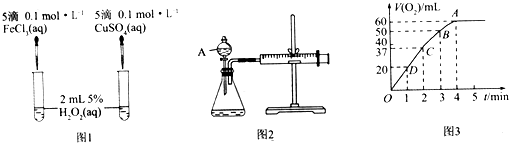
暑假作业暑假快乐练西安出版社系列答案【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%