题目内容
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了图1、图2两种实验装置. 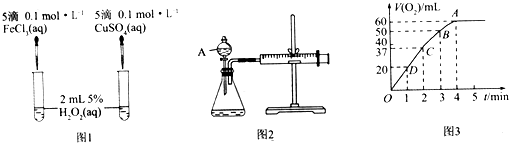
(1)若利用图1实验,可通过观察产生气泡的快慢定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 , 写出H2O2在二氧化锰催化作用下发生反应的化学方程式: . 若利用图2实验可进行定理分析,图中仪器A的名称为 , 实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是 .
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: , H2O2初始物质的量浓度为(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:
在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5molL﹣1的硫酸,10s时收集到产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为molL﹣1s﹣1(假设反应前后溶液的体积不变).
【答案】
(1)消除阴离子不同对实验的干扰;2H2O2 ![]() ?2H2O+O2↑;分液漏斗;产生40mL气体所需的时间
?2H2O+O2↑;分液漏斗;产生40mL气体所需的时间
(2)随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L
(3)0.005
【解析】解:(1)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位,如果不恢复原位,则证明气密性良好,否则不好;根据v=
2H2O+O2↑,A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位,如果不恢复原位,则证明气密性良好,否则不好;根据v= ![]() 知,还需要测定产生40mL气体所需的时间,所以答案是:消除阴离子不同对实验的干扰;2H2O2
知,还需要测定产生40mL气体所需的时间,所以答案是:消除阴离子不同对实验的干扰;2H2O2 ![]() 2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2 , H2O2的分解反应为2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2 , H2O2的分解反应为2H2O2 ![]() 2H2O+O2↑,则n(H2O2)=
2H2O+O2↑,则n(H2O2)= ![]() ×2≈0.00536 mol,c(H2O2)=
×2≈0.00536 mol,c(H2O2)= ![]() ≈0.11 mol/L,所以答案是:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
≈0.11 mol/L,所以答案是:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)
Zn | ~ | H2SO4 | ~ | H2 |
65g | 1mol | 22.4L | ||
0.13g | 0.002mol | 0.0448L |
用硫酸表示10s内该反应的速率为v= ![]() ÷10s=0.005molL﹣1s﹣1 , 所以答案是:0.005.
÷10s=0.005molL﹣1s﹣1 , 所以答案是:0.005.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案