题目内容
【题目】某元素R的原子核外电子数等于核内中子数,2.8 g该元素(设其相对原子质量与R原子的质量数相等)的单质R与氧气充分反应,可得到6.0 g化合物RO2,则下列有关说法错误的是( )
A.该元素原子的质子数为13
B.该元素原子的中子数为14
C.该元素原子的最外层电子数为4
D.该元素原子具有3个电子层
【答案】A
【解析】
根据化合物RO2的化学式R元素与O元素的关系,再根据M=![]() ,确定R元素的摩尔质量,摩尔质量在数值上等于其相对原子质量,相对原子质量在数值上等于该原子的质量数,再根据该原子的原子核外电子排布确定各个电子层上的电子数及元素名称。
,确定R元素的摩尔质量,摩尔质量在数值上等于其相对原子质量,相对原子质量在数值上等于该原子的质量数,再根据该原子的原子核外电子排布确定各个电子层上的电子数及元素名称。
该元素的单质2.8 g与氧气充分反应,生成6.0 g的化合物RO2,需要氧气的质量为6.0 g-2.8 g=3.2g,n(O)=![]() =0.2 mol,化合物RO2中R与O原子个数比为1:2,所以R的物质的量为0.1 mol,设R的摩尔质量为M g/mol,则n(R)=
=0.2 mol,化合物RO2中R与O原子个数比为1:2,所以R的物质的量为0.1 mol,设R的摩尔质量为M g/mol,则n(R)=![]() =0.1 mol,所以M=28,根据元素R的原子核外电子数等于核内中子数,所以该元素原子序数为28÷2=14,该元素为Si元素。
=0.1 mol,所以M=28,根据元素R的原子核外电子数等于核内中子数,所以该元素原子序数为28÷2=14,该元素为Si元素。
A. 该元素是Si元素,质子数为14,A错误;
B. 该元素原子相对原子质量是28,由于原子核外电子数等于核内中子数,原子核外电子数等于核内质子数,所以其中子数为14,B正确;
C. Si是14号元素,原子核外电子排布为2、8、4,原子的最外层电子数为4,C正确;
D. Si是14号元素,原子核外电子排布为2、8、4,可见原子核外具有3个电子层,D正确;
故合理选项是A。

【题目】下表列出了9种元素在周期表中位置,用化学符号回答下列问题。
周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
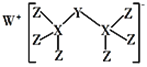
(1)这九种元素中:化学性质最不活泼的是__;金属性最强的是:__,最高价氧化物的水化物酸性最强的酸是__,最高价氧化物的水化物碱性最强的碱的电子式__。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是__。
(3)A、B、C三种元素按离子半径由大到小的顺序排列为__。
(4)F的最常见氢化物的电子式__;该氢化物在常温下跟B发生反应的化学方程式是__。
(5)C元素跟G元素形成的化合物的电子式是__,用电子式表示其形成过程为__。