题目内容
【题目】已知氢硫酸与碳酸的电离平衡常数分别为
H2S: ![]()
![]()
H2CO3: ![]()
![]()
请回答下列问题:
(1)室温下,0.1mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_________________,其原因是______________________________________________;
(2)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象:___________________________________________。
【答案】 硫化钠溶液 氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强 饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成
【解析】(1)酸越弱,相应的盐越容易水解,溶液的碱性就越强。根据电离平衡常数可知,氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强;(2)饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成,故向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
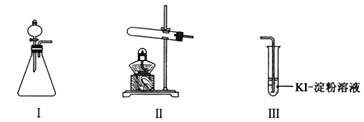
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。