题目内容
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________________。
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是___________;此时c(HCN)/c(CN-)=______________。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为__________ mol/L。
【答案】Na2CO3 ②>①>③ CN- +H2O![]() HCN+OH- 2 2×10-5
HCN+OH- 2 2×10-5
【解析】
(1)①由表格提供的电离常数可知,酸性HCOOH> H2CO3> HCN>HCO3-;根据酸性越弱对应酸根离子水解能力越强,也就是结合质子的能力越强原理可知,水解能力CO32->CN-> HCO3->HCOO-,故阴离子结合质子能力最强的是Na2CO3;
正确答案:Na2CO3。
②c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4 根据电离常数可知,物质的量浓度C(HCN)>C(HCOOH),HCN和HCOOH浓度远远大于硫酸,所以当体积相同时,与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是②>①>③;
正确答案:②>①>③
(2)一定浓度的NaCN溶液pH=9,呈碱性的原因是CN- +H2O![]() HCN+OH- ;根据
HCN+OH- ;根据![]() 可得c(HCN)/c(CN-)=C(H+)/Ka(HCN)=10-9/(5.0×10-10)=2;
可得c(HCN)/c(CN-)=C(H+)/Ka(HCN)=10-9/(5.0×10-10)=2;
正确答案:CN- +H2O![]() HCN+OH- 2 。
HCN+OH- 2 。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,C(CO32-)= ![]() ×5.6×l0-4=2.8×l0-4mol/L,根据Ksp=2.8×l0-9=C(Ca2-)×C(CO32-)可知。C(Ca2-)=(2.8×l0-9)/(2.8×l0-4)= l0-5 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×l0-5 mol/L;
×5.6×l0-4=2.8×l0-4mol/L,根据Ksp=2.8×l0-9=C(Ca2-)×C(CO32-)可知。C(Ca2-)=(2.8×l0-9)/(2.8×l0-4)= l0-5 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×l0-5 mol/L;
正确答案:2×l0-5 。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
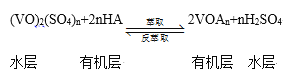
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。