题目内容
7.关于强、弱电解质的有关叙述错误的是( )| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 | |
| D. | 纯净的强电解质在液态时,有的导电,有的不导电 |
分析 A、强弱电解质的本质区别是在溶液中能否完全电离;
B、导电能力与溶液中离子浓度有关,与强弱电解质没有必然关系;
C、温度和浓度对弱电解质的电离程度有影响;
D、NaCl、K2SO4液态时导电,AlCl3、HCl液态时不导电.
解答 解:A、强电解质在溶液中能够完全电离为离子,弱电解质只能部分电离,故A正确;
B、导电能力与溶液中离子浓度有关,与强弱电解质没有必然关系,即强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱,故B错误;
C、当浓度相同时,温度升高,促进弱电解质的电离,溶液的导电能力越强;当温度相同时,增大浓度,虽然弱电解质的电离程度变小,但离子浓度增大,导电能力增强,故C正确;
D、离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl、K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3、HCl等,它们的熔点都较低,故D正确;
故选B.
点评 本题考查强弱电解质与导电能力的关系,难度不大,注意离子化合物类强电解质,液态时导电,它们都含有活泼的金属和活泼非金属,且熔点都高.如NaCl,K2SO4等,共价化合物类强电解质,液态时不导电,如AlCl3,HCl等.

练习册系列答案
相关题目
17.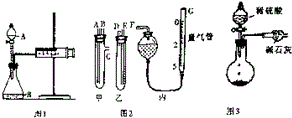 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
(1)甲同学用图1所示装置,把Ng的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积,实验开始时检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气.
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛有稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于甲、乙仪器中(填仪器编号);G管可用化学实验室里的一种常用仪器来代替,你认为这种仪器的名称是碱式滴定管;仪器甲、乙、丙接口的连接方式如下:A连接D,B连接E,C连接F(填写各接口的编号).
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,使测定结果可能偏小的主要原因可能是装置中的CO2没有全部被碱石灰吸收;(上述偏大、偏小的原因各写一条)
(4)某天然碱可看作向CO2和NaOH的反应后的产物所组成,称取天碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30毫升,产生CO2的体积(标准状况)如下表:
取3.28g天然碱样品于300℃加热至分解完全(300℃Na2CO3不分解),产生CO2224mL(标准状况)和一定量的水,则该天然碱样品的化学式为Na2CO3•2NaHO3•3H2O.
 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.(1)甲同学用图1所示装置,把Ng的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积,实验开始时检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气.
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛有稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于甲、乙仪器中(填仪器编号);G管可用化学实验室里的一种常用仪器来代替,你认为这种仪器的名称是碱式滴定管;仪器甲、乙、丙接口的连接方式如下:A连接D,B连接E,C连接F(填写各接口的编号).
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,使测定结果可能偏小的主要原因可能是装置中的CO2没有全部被碱石灰吸收;(上述偏大、偏小的原因各写一条)
(4)某天然碱可看作向CO2和NaOH的反应后的产物所组成,称取天碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30毫升,产生CO2的体积(标准状况)如下表:
| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
18.1919年,科学家第一次实现了人类多年的梦想--人工转变元素.这个核反应如下:${\;}_{7}^{14}$N+${\;}_{2}^{4}$He→${\;}_{8}^{17}$O+${\;}_{1}^{1}$H下列叙述正确的是( )
| A. | ${\;}_{8}^{17}$O原子核内有9个质子 | B. | H原子核内有1个中子 | ||
| C. | O2和O3互为同位素 | D. | 32He和42He是两种不同的核素 |
2.将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是( )
| A. | 生成的气体体积为1.12 L | |
| B. | 铜片溶解,生成物冷却后倒入盛有水的烧杯中,溶液成蓝色 | |
| C. | 参加反应的硫酸与被还原的硫酸物质的量之比为2:1 | |
| D. | 该实验中可用Na2CO3溶液处理尾气 |
12.下列各组物质,属于同分异构体的是( )
| A. | 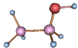 与 与 | B. |  和 和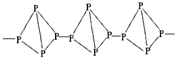 | ||
| C. | ${\;}_{1}^{1}$H2和${\;}_{1}^{2}$H2 | D. | H2O与H2O2 |
16.规范实验操作是获得实验成功的重要保证.下列实验操作错误的是( )
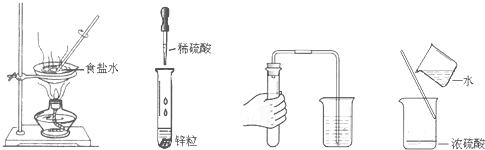

| A. | 蒸发食盐水 | B. | 滴管的使用 | C. | 检查装置气密性 | D. | 稀释浓硫酸 |
17.1L 0.2mol/L的KI溶液中,含溶质KI的物质的量是( )
| A. | 0.2mol | B. | 0.5mol | C. | 2mol | D. | 5mol |
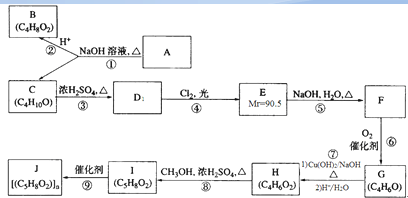
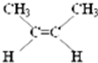 、CH2=CHCH2CH3;
、CH2=CHCH2CH3;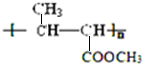 ;
;
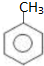 .
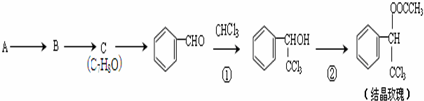
.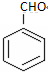 的核磁共振氢谱图中有4组峰.
的核磁共振氢谱图中有4组峰.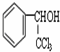 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$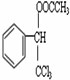 +H2O.
+H2O.