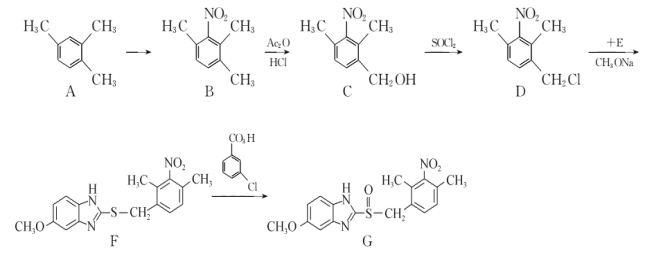
题目内容
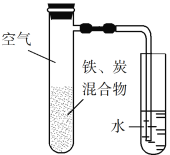
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
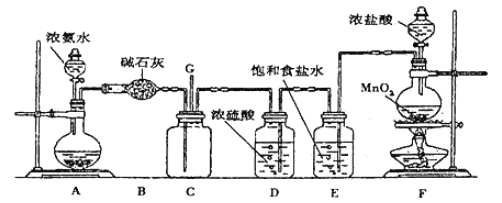
(1)装置A中的烧瓶内固体不能选用_____________。
A.生石灰 B.碱石灰
C.五氧化二磷 D.烧碱
(2)装置A中发生反应的化学方程式为________________________。
(3)B装置的作用_____________;E装置的作用_____________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式:___________。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,写出离子方程式________________;
实验室制备氨气,下列方法中适宜选用的是________________________。
①固态氯化铵加热分解
②浓氨水中加入固体氢氧化钠
③加热浓氨水
④固态氯化铵与氢氧化钙混合加热
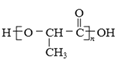
【答案】C NH3·H2O ![]() NH3↑+H2O 干燥气体 吸收HCl 8NH3+3Cl2=N2+6 NH4Cl Cl2+2OH-=Cl-+C1O-+H2O ②③④
NH3↑+H2O 干燥气体 吸收HCl 8NH3+3Cl2=N2+6 NH4Cl Cl2+2OH-=Cl-+C1O-+H2O ②③④
【解析】
(1)五氧化二磷为酸性氧化物与氨气反应,故不能选用;
(2)装置A中一水合氨分解生成氨气;
(3)碱石灰可以干燥氨气,饱和食盐水可以除去氯气中的氯化氢杂质;
(4)氨气和氯气反应生成氯化铵和氮气;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
①加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,结合一水合氨电离平衡移动影响因素;
③一水合氨受热分解生成氨气;
④固态氯化铵与氢氧化钙混合加热生成氨气。
(1)生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;氢氧化钠溶于水放热,促使氨水分解,且OH-的浓度增大有利于NH3的生成,所以可以用将浓氨水逐滴滴加到生石灰、碱石灰或烧碱上制取氨气,五氧化二磷为酸性氧化物与氨气反应,故不能选用,
故答案选C;
(2)装置A中一水合氨分解生成氨气,化学方程式为NH3·H2O ![]() NH3↑+H2O,
NH3↑+H2O,
故答案为:NH3·H2O ![]() NH3↑+H2O;
NH3↑+H2O;
(3)B装置中,可以用碱石灰干燥氨气,E装置中,可以用饱和食盐水除去氯气中的氯化氢杂质;
故答案为:干燥气体;除去氯气中的氯化氢;
(4)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即反应的化学方程式为8NH3+3Cl2═6NH4Cl+N2;
故答案为:8NH3+3Cl2═6NH4Cl+N2;
(5)氯气是酸性气体,可以用氢氧化钠来进行尾气处理,反应的离子方程式为Cl2+2OH-=Cl-+C1O-+H2O,
故答案为:Cl2+2OH-=Cl-+C1O-+H2O;
①加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,不能制得氨气,故①错误;
②固体氢氧化钠溶于水放热,电离产生氢氧根离子,氢氧根离子浓度增大,抑制了NH3·H2O的电离,有利于氨气的逸出,故②正确;
③一水合氨受热分解生成氨气,故③正确;
④固态氯化铵与氢氧化钙混合加热生成氨气,能够制得氨气,故④正确;
故选:②③④。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
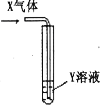
名题金卷系列答案【题目】将足量X气体通入Y溶液中,实验结果与预测现象一致的组合是( )
X气体 | Y溶液 | 预测现象 |
| |
① | CO2 | Na2SiO3溶液 | 有白色沉淀产生 | |
② | SO2 | BaCl2溶液 | 有白色沉淀产生 | |
③ | Cl2 | AgNO3溶液 | 有白色沉淀产生 | |
④ | NH3 | AlCl3溶液 | 有白色沉淀产生 |
A.只有①②③B.只有①②④
C.只有①③④D.①②③④