题目内容
【题目】常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3 H2O) =10-5,下列叙述正确的是
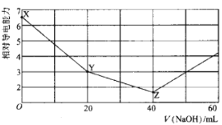
A.X→Y 过程中发生反应的离子方程式为:![]() +OH-= NH3 H2O
+OH-= NH3 H2O
B.Y点满足:c(![]() ) +c(Na+) =2c(
) +c(Na+) =2c(![]() )
)
C.水的电离程度:X>Y>Z
D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 molL-1
【答案】D
【解析】
从图中可知,Z点时溶液的导电能力最弱,表明此时NH4HSO4与NaOH刚好完全反应,生成Na2SO4和NH3 H2O;则X→Y过程中只发生H++OH-=H2O,溶质为NaNH4SO4。
A.NH4HSO4溶液中滴加NaOH溶液,H+与OH-先发生反应,![]() 与OH-后发生反应,X→Y过程中发生反应的离子方程式为:H++OH-=H2O,A不正确;
与OH-后发生反应,X→Y过程中发生反应的离子方程式为:H++OH-=H2O,A不正确;
B.Y点时,溶质为NaNH4SO4,pH<7,满足电荷守恒:c(![]() ) +c(Na+) + c(H+) =2c(
) +c(Na+) + c(H+) =2c(![]() )+c(OH-),由于c(H+)> c(OH-),所以c(
)+c(OH-),由于c(H+)> c(OH-),所以c(![]() ) +c(Na+)<2c(
) +c(Na+)<2c(![]() ),B不正确;
),B不正确;
C.X点溶质为NH4HSO4溶液,硫酸氢铵电离出的H+将抑制水的电离,Y点溶质为NaNH4SO4,因![]() 水解促进水的电离,Z点溶质为Na2SO4和NH3 H2O,水的电离受到抑制,但比X点对水的抑制作用弱,所以水的电离程度:Y>Z >X,C不正确;
水解促进水的电离,Z点溶质为Na2SO4和NH3 H2O,水的电离受到抑制,但比X点对水的抑制作用弱,所以水的电离程度:Y>Z >X,C不正确;
D.若Z点溶液pH=1l,则此时溶液中发生一水合氨的电离:NH3·H2O![]()
![]() +OH-,则Kb=
+OH-,则Kb=![]() ,即
,即![]() =10-5,氨水浓度约为0.1 molL-1,D正确;
=10-5,氨水浓度约为0.1 molL-1,D正确;
故选D。

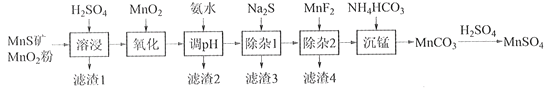
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。