题目内容
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.2kJ/mol
CO(g)+H2O(g) △H2=+41.2kJ/mol
III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
某些物质的标准生成热 | ||||
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。化学反应热:ΔH=生成物标准生成热总和一反应物标准生成热总和。计算 △H1=_____kJ/mol。
(2)在一容积可变的密团容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
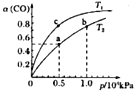
①a、b两点的反应速率:v(a)___v(b)(填“>”、“<”或“=”)
②T1____T2(填“>”、“<"或“=”),原因是___________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是_____(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数Kp____(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用下图简单表示,则阳极发生的电极反应为_________。
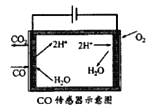
【答案】-90.73<<CO(g)+2H2(g)![]() CH3OH(g)是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2bc1.6×10-7(kPa)-2CO+H2O-2e-=CO2+2H+
CH3OH(g)是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2bc1.6×10-7(kPa)-2CO+H2O-2e-=CO2+2H+
【解析】
(1)反应热=反应物总键能-生成物总键能,故△H1=-201.25kJ/mol+110.52kJ/mol-0=-90.73kJ/mol;(2) ①b点压强大,压强越大,反应速率越大,则a、b两点的反应速率:v(a) <v(b);②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,一氧化碳的转化率减小,故T1<T2;③a.只要反应发生就有H2的消耗速率是CH3OH生成速率的2倍,故错误;b.CH3OH的体积分数不再改变,说明各物质的量不变,反应达到平衡状态,故正确;C.混合气体的密度不再改变,说明气体的物质的量不变,反应达到平衡状态,故正确;d.CO和CH3OH的物质的量之和保持不变,可能平衡也可能未平衡,故错误。答案选bc;④图2中a点CO的转化率为0.5,总压强为0.5![]() 106Pa,依据化学平衡三段式列式计算,
106Pa,依据化学平衡三段式列式计算,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 1 0.5
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,平衡常数Kp=![]() =
=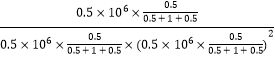 =1.6
=1.6![]() (kPa)-2;(3)阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳同时生成氢离子,电极反应为:CO+H2O-2e-=CO2+2H+。
(kPa)-2;(3)阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳同时生成氢离子,电极反应为:CO+H2O-2e-=CO2+2H+。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案