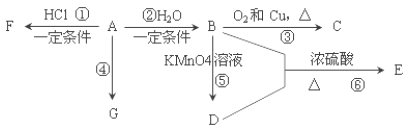
题目内容
【题目】Ⅰ.(1)①向明矾溶液中逐滴滴入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH________7(填>或<或=),离子反应总方程式为______________;
②向明矾溶液中逐滴加氢氧化钡溶液至铝离子刚好沉淀完全时,溶液的pH________7(填>或<或=),离子反应总方程式为______________。
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为_____________________________________。
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2 mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)____→____→____→ D →____
(2)使用滴定管之前应进行的操作是__________________。
(3)恰好达到滴定终点时的实验现象为_________________________________________。
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响__________(填“偏高”、“偏低”或“无影响”)。
(5)该烧碱样品的纯度计算式是________________________________。
【答案】> Al3++ 2SO42-+2Ba2++4OH-=AlO2-+ 2BaSO4↓+2H2O = 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ ①=②>③ C A B E 检查是否漏液 溶液刚好由红色变为无色,且半分钟内不恢复 偏高 ![]()
【解析】
I.(1)①明矾的电离方程式为:KAl(SO4)2═K++Al3++2SO42-。假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后偏铝酸根离子水解,溶液呈碱性,pH>7,故答案为:>;Al3++ 2SO42-+2Ba2++4OH-=AlO2- + 2BaSO4↓+2H2O;
②假设明矾的物质的量为1mol,水溶液中含2molSO42-,1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为2:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液中的溶质为硫酸钾,溶液呈中性,pH=7,故答案为:=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;
(2)(NH4)2SO4与NH4Cl溶液都是强酸弱碱盐,相同pH的(NH4)2SO4与NH4Cl溶液中铵根离子的水解程度相同,说明NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,则溶液中铵根离子浓度大小为:①=②>③,故答案为:①=②>③;
Ⅱ.(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,具体步骤为:C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解;A.在250mL容量瓶中定容成250mL烧碱溶液;B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂;D.将物质的量浓度为Mmol/L的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL,即正确的操作步骤的顺序为CABDE,故答案为:C;A;B;E;
(2)为了避免滴定管漏液,影响滴定结果,则在中和滴定前需要检查滴定管是否漏水,故答案为:检查是否漏液;
(3)指示剂为酚酞,用盐酸滴定氢氧化钠溶液,当溶液刚好由红色变为无色,且半分钟内不恢复红色,表明达到了滴定终点,故答案为:溶液刚好由红色变为无色,且半分钟内不恢复;
(4)若酸式滴定管未用盐酸标准溶液润洗,标准液被稀释,标准液的浓度变小,滴定时消耗的标准液体积偏大,根据c(待测)=![]() ,测定结果偏高,故答案为:偏高;
,测定结果偏高,故答案为:偏高;
(5)滴到消耗的HCl的物质的量为:n(HCl)=cV=(V2-V1)×10-3L×Mmol/L,根据反应方程可知,n(NaOH)=n(HCl)=M(V2-V1)×10-3mol,原样品中氢氧化钠的物质的量为:M(V2-V1)×10-3mol×![]() =M(V2-V1)×10-2mol,该氢氧化钠的质量为:m(NaOH)=nM=40M(V2-V1)×10-2g,
=M(V2-V1)×10-2mol,该氢氧化钠的质量为:m(NaOH)=nM=40M(V2-V1)×10-2g,
所以该烧碱样品的纯度为:![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.2kJ/mol
CO(g)+H2O(g) △H2=+41.2kJ/mol
III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
某些物质的标准生成热 | ||||
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。化学反应热:ΔH=生成物标准生成热总和一反应物标准生成热总和。计算 △H1=_____kJ/mol。
(2)在一容积可变的密团容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
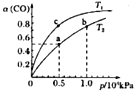
①a、b两点的反应速率:v(a)___v(b)(填“>”、“<”或“=”)
②T1____T2(填“>”、“<"或“=”),原因是___________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是_____(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数Kp____(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
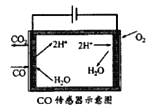
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用下图简单表示,则阳极发生的电极反应为_________。
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应吸热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。