题目内容
【题目】Na2S2O3·5H2O常用作冲洗照相底片的定影剂,实验室以Na2S、Na2CO3、SO2为原料,利用下图装置可制取少量Na2S2O3·5H2O,其实验原理为Na2CO3+SO2=Na2S2O3+CO2;2Na2S+3SO2==2Na2SO3+3S;Na2SO3+S=Na2S2O3。回答下列问题:
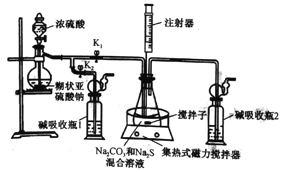
(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,锥形瓶中的现象是: ①导管口有气泡冒出;②__________________。
(2)通过注射器取样,监控锥形瓶中溶液pH=7~8,锥形瓶中酸性不能过强的原因是_______。当锥形瓶中溶液的pH接近7时,应进行的操作是__________________________。
(3)反应结束后将锥形瓶中混合液经如下处理可Na2S2O3·5H2O粗晶体:
![]()
①趁热过滤的目的是______________________。
②粗晶体中含有Na2CO3、Na2SO3、Na2SO4等杂质,利用下列提供的试剂,检验粗产品中含有Na2CO3。
可选试剂: a.品红溶液 b.酸性高锰酸钾溶液 c.澄清石灰水 d.NaOH溶液 e.稀硫酸
实验方案:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、_____(填试剂序号)、澄清石灰水,若______(填现象),则证明产品中含有Na2CO3。
(4)粗晶体中Na2S2O3·5H2O质量分数的测定:称取2.500g粗晶体溶于水,配成100mL溶液,取25.00mL溶液于锥形瓶中,用0.4000 mol/L的酸性高锰酸钾标准溶液滴定,消耗标准溶液的体积为10.00mL,Na2S2O3·5H2O的质量分数为______ (忽略杂质对滴定的影响;S2O32-被酸性高锰酸钾溶液氧化为SO42-)。
【答案】 溶液中出现黄色浑浊(或淡黄色),后又逐渐变澄清 Na2S2O3在酸性较强的环境中会发生反应,降低Na2S2O3·5H2O产率 关闭滴液漏斗活塞,关闭K1,打开K2 防止Na2S2O3因温度降低析出,而造成损失 a 酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊 99.2%
【解析】(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,亚硫酸钠与浓硫酸反应生成二氧化硫气体,二氧化硫与硫化钠反应生成硫单质,2Na2S+3SO2==2Na2SO3+3S;随后有发生Na2SO3+S=Na2S2O3,溶液变澄清,故答案为:溶液中出现黄色浑浊(或淡黄色),后又逐渐变澄清;
(2)通过注射器取样,监控锥形瓶中溶液pH=7~8,因为Na2S2O3在酸性较强的环境中会发生反应,会降低Na2S2O3·5H2O产率,因此锥形瓶中酸性不能过强;当锥形瓶中溶液的pH接近7时,需要关闭滴液漏斗活塞,使反应停止,同时关闭K1,打开K2,用碱液吸收多余的二氧化硫,故答案为:Na2S2O3在酸性较强的环境中会发生反应,降低Na2S2O3·5H2O产率;关闭滴液漏斗活塞,关闭K1,打开K2;
(3)①趁热过滤可以防止Na2S2O3因温度降低析出,而造成损失,故答案为:防止Na2S2O3因温度降低析出,而造成损失;
②检验粗产品中含有Na2CO3:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、除去二氧化硫,然后用品红溶液检验二氧化硫是否除净,再用澄清石灰水具有生成的二氧化碳,若酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊,则证明产品中含有Na2CO3,故答案为:a;酸性高锰酸钾溶液颜色变浅,品红溶液不褪色,澄清石灰水变浑浊;
(4) 酸性高锰酸钾标准溶液滴定Na2S2O3·5H2O的反应方程式为5S2O32-+ 8MnO4-+ 14H+= 10SO42-+8 Mn2++7H2O,反应消耗的高锰酸钾的物质的量为0.4000mol/L×0.0100L=0.004mol,则n(S2O32-)=![]() ×0.004mol=0.0025mol,因此Na2S2O3·5H2O的质量分数=
×0.004mol=0.0025mol,因此Na2S2O3·5H2O的质量分数=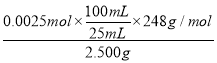 ×100%=99.2%,故答案为:99.2%。
×100%=99.2%,故答案为:99.2%。

【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
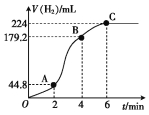
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。