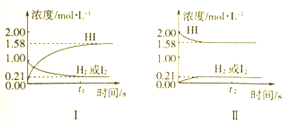题目内容
18.下列的各组离子在酸性溶液中能大量共存的是( )| A. | Na+、Fe2+、NO3-、Cl- | B. | Ca2+、K+、Cl-、NO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
分析 酸性溶液中存在大量氢离子,与氢离子反应的离子不能大量共存,
A.铁离子、硝酸根离子在酸性条件下发生氧化还原反应;
B.四种离子之间不反应,能够共存;
C.铝离子与氢氧根离子反应;
D.钙离子与硅酸根离子反应.
解答 解:A.Fe2+、NO3-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Ca2+、K+、Cl-、NO3-离子之间不发生反应,在溶液中可以大量共存,故B正确;
C.Al3+、OH-之间反应,在溶液中大量共存,故C错误;
D.Ca2+、SiO32-之间反应生成硅酸钙沉淀,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
9.下列各组混合物中,总质量一定时,二者以不同比例混合,完全燃烧时生成CO2的质量一定的是( )
| A. | 甲烷、辛醛 | B. | 乙炔、苯乙烯 | C. | 乙烯、乙烷 | D. | 苯、甲苯 |
10.NA表示阿伏伽德罗常数的值,下列关于0.2mol•L-1 K2SO4溶液的说法正确的是( )
| A. | 1000mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.4mol•L-1 | |
| D. | 1L溶液中SO4 2-的浓度是0.4mol•L-1 |
8.下列各组物质中都是由分子构成的化合物是( )
| A. | CO2、NO2、SiO2 | B. | HCl、NH3、CH4 | C. | NO、CO、CaO | D. | O2、N2、Cl2 |

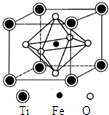 钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
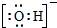 .
.
 .
.