题目内容
6. 钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
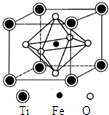
钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.(1)钛铁矿的晶胞如图所示,其化学式为FeTiO3.
(2)Ti元素的基态原子的电子排布式为1s22s22p63s23p63d24s2.
(3)将钛铁矿与焦炭混合,通入氯气并加热制得TiCl4,将TiCl4蒸馏提纯,在氩气保护下与镁共热得到钛.TiCl4属于分子晶体(填写晶体类型).
(4)二氧化钛作光催化剂能将室内污染物甲醛、苯等有害气体转化为CO2和H2O.
①甲醛分子的空间构型是平面三角形.
②C、H、O元素电负性由大到小的顺序为:O、C、H.
③甲醛极易溶于水,试解释其原因甲醛分子与水分子间形成氢键.
(5)已知Ti3+可形成配位数为6的配合物.现有钛的两种颜色的配合物,一种为紫色,另一种为绿色,相关实验证明,两种物质的组成皆为TiCl3•6H2O.为测定这两种配合物的成键情况,设计了如下实验:
①分别取等质量的两种物质的样品配成溶液;
②分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;
③测定沉淀质量并比较,发现由绿色物质得到沉淀的质量是紫色物质得到沉淀的质量的$\frac{2}{3}$.则绿色晶体的化学式为[TiCl(H2O)5]Cl2•H2O.
分析 (1)根据晶胞结构,利用均摊法计算晶胞中各原子的个数比,进而确定化学式;
(2)Ti为22号元素,根据核外电子排布规律书写电子排布式;
(3)根据晶体的熔沸点判断晶体类型;
(4)①根据中心原子的价层电子对数判断分子空间构型;
②根据元素周期律判断电负性;
③甲醛与水分子之间能形成氢键;
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 $\frac{2}{3}$,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子.
解答 解:(1)根据晶胞结构,晶胞中含有的O原子数为6×$\frac{1}{2}$=3,Ti原子数为为$8×\frac{1}{8}$=1,Fe原子数为1,它们的原子个数比为3:1:1,所以化学式为FeTiO3,
故答案为:FeTiO3;
(2)Ti为22号元素,核外电子排布式为1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(3)TiCl4能蒸馏提纯,所以TiCl4的沸点较低,应为分子晶体,
故答案为:分子晶体;
(4)①甲醛分子中,碳原子的价层电子对数为$\frac{4+2}{2}$=3,没有孤电子对,所以分子空间构型是平面三角形,
故答案为:平面三角形;
②根据元素周期律,同周期从左向右元素电负性增大,同主族从上向下,元素的电负性减小,所以C、H、O元素电负性由大到小的顺序为O、C、H,
故答案为:O、C、H;
③甲醛与水分子之间能形成氢键,所以甲醛极易溶于水,
故答案为:甲醛分子与水分子间形成氢键;
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 $\frac{2}{3}$,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,Ti3+的配位数均为6,故绿色晶体的化学式为[TiCl(H2O)5]Cl2•H2O,
故答案为:[TiCl(H2O)5]Cl2•H2O.
点评 本题考查核外电子排布、配合物,难度中等,注意配合物的內界和外界,在水溶液里配合物的外界能产生自由移动的离子.

| A. | 127R-的核外含有53电子 | |
| B. | Y、Z、R的氢化物的稳定性逐渐减弱 | |
| C. | Z的单质易挥发,可以水封保存 | |
| D. | 在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5mol•L-1 |
| 细菌总数 | <100个/mL |
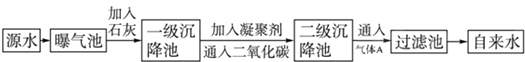
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3溶液$\stackrel{△}{→}$Fe2O3 | |
| B. | 饱和NaCl(aq) $\stackrel{先通NH_{3},再通CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq) $\stackrel{足量稀H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{HCl(aq)}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg |

| A. | 温度相同(>t1℃)时,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数 | |
| B. | t1℃时,KNO3、NaCl饱和溶液中溶质的物质的量浓度相等 | |
| C. | 用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体 | |
| D. | 将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g |
| A. | Na+、Fe2+、NO3-、Cl- | B. | Ca2+、K+、Cl-、NO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
| A. | 2 | B. | 1.7 | C. | 12 | D. | 12.3 |
| A. | H2和D2 | B. | 金刚石和石墨 | ||
| C. | CO和CO2 | D. | ${\;}_{17}^{37}$Cl和${\;}_{17}^{35}$Cl |