题目内容
已知反应:①101kPa时,C(s)+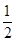 O2(g)═CO(g)△H1=-110.5kJ/mol
O2(g)═CO(g)△H1=-110.5kJ/mol
②稀溶液中:H+(aq)+ OH-(aq )═H2O(l) △H2=-57.3kJ/mol
下列说中正确的是
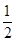 O2(g)═CO(g)△H1=-110.5kJ/mol
O2(g)═CO(g)△H1=-110.5kJ/mol②稀溶液中:H+(aq)+ OH-(aq )═H2O(l) △H2=-57.3kJ/mol
下列说中正确的是
| A.若碳的燃烧热用△H3表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量 |
A
试题分析:A、碳的燃烧热:完全燃烧1molC生成最稳定氧化物二氧化碳所释放的热量,碳完全燃烧放热比不完全燃烧放热多,即△H3<△H1,故A正确;B、碳的燃烧热:完全燃烧1molC生成最稳定氧化物二氧化碳所释放的热量,碳完全燃烧放热比不完全燃烧放热多,即△H3<△H1,故B错误;C、浓硫酸的稀释过程是放热的,浓硫酸与稀NaOH溶液反应的中和热大于57.3kJ/mol,故C错误;D、醋酸是弱电解质,存在电离平衡,醋酸的电离过程是吸热的,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ,故D错误,故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 N2H4(g)+
N2H4(g)+ a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?) (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

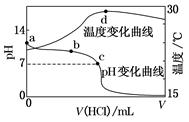
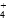 )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-) )
)