题目内容
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:

(1)装置A中发生反应的化学方程式:_________。
(2)装置D中试管口放置浸有NaOH溶液的棉花,其作用是______。
(3)装置B中应放置的液体是______。
(4)反应完毕,发现烧瓶中有铜片剩余,下列药品中能用来证明反应结束后的烧瓶中确有余酸的是______(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 吸收多余的二氧化硫气体,防止污染空气 饱和NaHSO3溶液 ad
CuSO4+SO2↑+2H2O 吸收多余的二氧化硫气体,防止污染空气 饱和NaHSO3溶液 ad
【解析】
在装置A中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,在装置B中可以储存SO2,缓冲气流,而不溶解、吸收SO2,在装置C中收集SO2,装置D中品红溶液检验SO2的漂白性,棉花上的NaOH溶液是吸收多余SO2,防止污染大气,可根据H2SO4电离产生H+的性质检验有硫酸剩余。
(1)装置A中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)二氧化硫气体排放到大气中会污染环境,所以装置D中试管口放置的棉花中应浸一种液体能与二氧化硫反应,可以浸氢氧化钠溶液或碳酸钠溶液等碱性溶液,作用是吸收多余的二氧化硫气体,防止污染空气;
(3)装置B可以适量储存SO2,缓冲气流,而不能反应消耗SO2,也不能溶解SO2气体。由于二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫,应该使用的溶液是饱和NaHSO3溶液;
(4)能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
a.铁粉与稀硫酸反应放气体,可以证明稀硫酸有剩余,a正确;
b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,不能证明稀硫酸有剩余,b错误;
c.银粉不与稀硫酸反应,不能证明稀硫酸有剩余,c错误;
d.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明稀硫酸有剩余,d正确;
故合理选项是ad。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易升华;③淀粉溶液遇到碘单质变蓝色;④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
水 | 四氯化碳 | |
溴 | 黄→棕 | 橙→橙红 |
碘 | 深黄→褐 | 紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)

实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是____________________________,写出该反应的化学方程式__________________________________;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________,写出该反应的离子方程式_______________________;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为____________;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点______________
【题目】根据图1、图2、图3及题中信息,回答下列问题
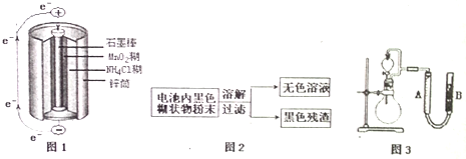
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 | 足量 |
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
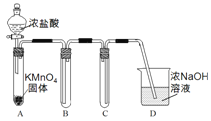
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。






