题目内容
【题目】VIA族的氧,硫,硒(Se),碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
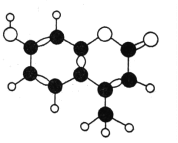
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______。
![]()
(2)Se原子序数为______,其核外M层电子的排布式为______。
(3)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________。
②H2SeO4比H2SeO3酸性强的原因:________________________。
【答案】sp3 34 3s23p63d10 强 平面正三角形 三角锥型 酸第一步电离产生的酸根阴离子带有负电荷,吸引H+ H2SeO4和H2SeO3可以分别表示为(HO)2SeO2,(HO)2SeO,H2SeO4中Se为+6价,而H2SeO3中Se为+4价,前者含有较多的非羟基O原子,故Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
【解析】
(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化;
(2)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上,所以其核外M层电子的排布式为3s23p63d10;
(3)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电离,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面正三角形,SO32-离子中S原子价层电子对个数=3+![]() (6+2-3×2)=4,且含有一个孤电子对,所以其立体构型为三角锥形;
(6+2-3×2)=4,且含有一个孤电子对,所以其立体构型为三角锥形;
(4)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度;
②H2SeO4和H2SeO3可以分别表示为(HO)2SeO2,(HO)2SeO,H2SeO4中Se为+6价,而H2SeO3中Se为+4价。前者含有较多的非羟基O原子,故Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案