题目内容
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
【答案】1:2 4H++2Cl-+MnO2![]() Cl2↑+Mn2++2H2O 2.24 HCl挥发 浓盐酸随反应进行变为稀盐酸,不再与MnO2反应 湿润的淀粉碘化钾
Cl2↑+Mn2++2H2O 2.24 HCl挥发 浓盐酸随反应进行变为稀盐酸,不再与MnO2反应 湿润的淀粉碘化钾
【解析】
该反应中,锰元素化合价降低,MnO2是氧化剂,氯元素化合价升高,HCl是还原剂,当4mol HCl 参加反应时,只有2mol氯元素从-1价升高为0价,被氧化;由于浓盐酸易挥发,且只有浓盐酸与二氧化锰反应,反应过程中浓盐酸会逐渐变稀,稀到一定程度反应不再进行;氯气可从碘化钾中置换出碘,碘遇淀粉变蓝色,据此分析解答。
(1)该反应中,锰元素化合价降低,MnO2是氧化剂,氯元素化合价升高,HCl是还原剂,当4mol HCl 参加反应时,只有2mol氯元素从-1价升高为0价,被氧化,即只有2mol HCl 起到还原剂的作用,因此,该反应中氧化剂与还原剂的物质的量比为1:2;
(2)该反应的离子方程式:4H++2Cl-+MnO2![]() Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
(3)氯元素从-1价升高为0价,每生成1mol Cl2,转移2mol电子。当有0.2mol电子转移时,生成0.1mol Cl2,这些氯气在标准状况下的体积为0.1mol×22.4L/mol=2.24L;
(4)50mL36.5%1.2g/mL浓盐酸中含有氯化氢的物质的量为![]() =0.6mol,根据反应4HCl(浓)+MnO2
=0.6mol,根据反应4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,若0.6molHCl完全反应转化为Cl2,生成Cl2的物质的量为0.15mol,标况下的体积为3.36L;由于浓盐酸易挥发,且只有浓盐酸与二氧化锰反应,反应过程中浓盐酸会逐渐变稀,稀到一定程度反应不再进行,因此0.6mol的HCl不能完全反应,则生成的Cl2的总物质的量小于0.15mol,标况下的体积也小于3.36L;
Cl2↑+MnCl2+2H2O,若0.6molHCl完全反应转化为Cl2,生成Cl2的物质的量为0.15mol,标况下的体积为3.36L;由于浓盐酸易挥发,且只有浓盐酸与二氧化锰反应,反应过程中浓盐酸会逐渐变稀,稀到一定程度反应不再进行,因此0.6mol的HCl不能完全反应,则生成的Cl2的总物质的量小于0.15mol,标况下的体积也小于3.36L;
(5)氯气可从碘化钾中置换出碘,碘遇淀粉变蓝色,因此,检验氯气是否收集满的方法是用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。

 寒假学与练系列答案
寒假学与练系列答案【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。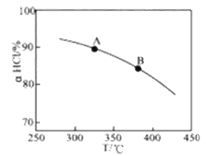
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。