题目内容
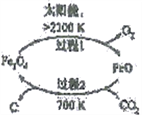
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是将传统的燃料与空气直接接触反应的燃烧借助于载氧剂(如Fe2O3、FeO等)的作用分解为几个气固反应,燃料与空气无需接触,由载气剂将空气中的氧传递给燃料。回答下列问题:
(1)用Fe2O3作载氧剂的化学链燃烧部分热化学方科式及循环转化的原理如下:
I.C(s)+H2O(g)==CO(g)+H2(g) △H1
II.Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) △H2
III.Fe2O3(s)+1/3H2(g)=2/3Fe3O4(s)+1/3H2O(g) △H3
IV.Fe3O4(s)+1/4O2(s)=3/2Fe2O3 (s) △H4
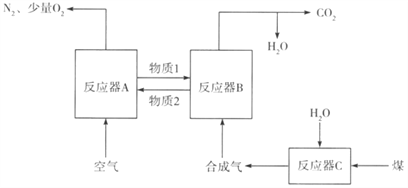
①在反应器B中进行的反应是_______(填反应前面的代号);“物质2”是______(填化学式)。
②反应C(s)+O2(g)=CO2(g)的△H=______(用△H1、△H2、△H3、△H4表示)。
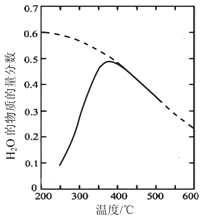
(2)用FeO作载氧剂部分反应的lgKp[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]与温度的关系如下图所示:
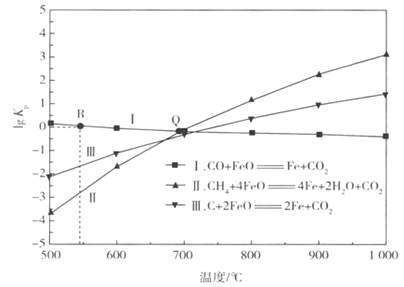
①图中涉及的反应中,属于吸热反应的是______(填反应前面的代号)。
②恒容密闭容器中进行反应:CH4(g) +4FeO(s)=4Fe(s) +2H2O(g)+CO2(g),不能说明该反应已达到化学平衡的标志是______( 填字母)。
a.v正(CH4)=v正(CO2)
b.气体的压强不再随时间变化
c.气体的密度不再随时间变化
d.单位时间内断裂C-H键与断裂H-O键数目相等
③若某恒容密闭容器中只发生反应I和II,平衡时对应上图中Q 处时,容器中气体分压p(X)间应满足的关系是__________。
④在某密闭容器中充入0.8 molCO和0.2 mol CO2 并加入足量的FeO,只发生反应I,在R点(lgKp=0),则CO的平衡转化率为________。
(3)若用CaSO4作载氧剂进行化学链燃烧时,CaSO4与CO发生反应生成CaS,则反应的化学方程式是__________________。
【答案】 II、III Fe3O4 △Hl+3△H2+3△H3+4△H4 II、III a p(CH4)=p(CO)·p2(H2O) 37.5% CaSO4+4CO![]() CaS+4CO2
CaS+4CO2
【解析】①由循环转化图可知,反应器A消耗空气中的氧气,生成了载氧剂,反应器B中载氧剂将合成气中的CO、H2分别氧化为CO和H2O,本身被还原,因此,在反应器B中进行的反应是II、III;“物质2”是Fe3O4。
②根据盖斯定律,反应C(s)+O2(g)=CO2(g)可由I+II×3+III×3+IV×4得到,因此,△H=△Hl+3△H2+3△H3+4△H4 ;
(2)①从lgKp与温度的关系图中可看出,反应II、III的lgKp随温度升高而增大,即升高温度平衡向正反应方向移动,故反应II、III属于吸热反应;
②CH4(g)+4FeO(s)![]() 4Fe(s)+2H2O(g)+CO2(g),a.v正(CH4)=v正(CO2),两个都表示正反应速率,不能说明已达平衡,应选a;b.由于两边气体分子数不相等,当气体的压强不再随时间变化,说明各成分含量不再改变,达到平衡;c.由于恒容,且FeO和Fe为固体,当气体的密度不再随时间变化,说明各组分物质的量不再改变,达到平衡;d.单位时间内断裂C-H键数目等于断裂H-O键数目,即甲烷的消耗速率等于水的消耗速率,说明v正=v逆,已达平衡;故选a。
4Fe(s)+2H2O(g)+CO2(g),a.v正(CH4)=v正(CO2),两个都表示正反应速率,不能说明已达平衡,应选a;b.由于两边气体分子数不相等,当气体的压强不再随时间变化,说明各成分含量不再改变,达到平衡;c.由于恒容,且FeO和Fe为固体,当气体的密度不再随时间变化,说明各组分物质的量不再改变,达到平衡;d.单位时间内断裂C-H键数目等于断裂H-O键数目,即甲烷的消耗速率等于水的消耗速率,说明v正=v逆,已达平衡;故选a。
③若只发生反应I和II,平衡时对应上图中Q处时,两条曲线相交,两个反应的平衡常数相等,因KI=p(CO2)/p(CO),KII=p2(H2O)p(CO2)/p(CH4),KI=KII,p(CH4)=p(CO)·p2(H2O);
④ CO(g)+FeO(s)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始物质的量(mol) 0.8 0.2
转化的物质的量(mol)x x
平衡时物质的量(mol)0.8-x 0.2+x
由于在R点(lgKp=0),则Kp=c(CO2)/c(CO)=n(CO2)/n/c(CO)=![]() =1 ,解得:x=0.3,则CO的平衡转化率为
=1 ,解得:x=0.3,则CO的平衡转化率为![]() ×100%=37.5%;
×100%=37.5%;
综上,本题答案为:a ;p(CH4)=p(CO)·p2(H2O); 37.5%
(3)CaSO4与CO发生氧化还原反应生成CaS,硫的化合价降低,根据氧化还原反应化合价升降规律,可判断另一产物为CO2则反应的化学方程式是CaSO4+4CO![]() CaS+4CO2,本题答案为:CaSO4+4CO
CaS+4CO2,本题答案为:CaSO4+4CO![]() CaS+4CO2。
CaS+4CO2。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案