题目内容
13.如表是三种物质的溶解度(20℃),下列说法正确的是( )| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的K=6.82×10-6moL-2•L-2则所含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6moL2-•L-2 | |
| B. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3 | |
| D. | 用石灰水处理含有Mg2+和HCO3的硬水,发生的离子反应的方程式为Mg2++2HCO3+Ca2+2OH═CaCO3↓+MgCO3↓+2H2O |
分析 A、饱和碳酸镁溶液中碳酸根离子浓度和镁离子浓度相同,浓度乘积是常数,当含有其他镁离子或碳酸根离子的混合溶液中,不一定存在碳酸根离子浓度和镁离子浓度相同;
B、氯化镁溶液蒸干得到水解产物,灼烧得到氧化镁,氢氧化镁蒸干灼烧得到氧化镁,碳酸镁溶液加热得到氢氧化镁,灼烧得到氧化镁;
C、碳酸镁是微溶于水的物质,需要用氢氧化钠溶液除去;
D、氢氧化镁溶解度小于碳酸镁,反应生成氢氧化镁沉淀.
解答 解:A、饱和碳酸镁溶液中碳酸根离子浓度和镁离子浓度相同,浓度乘积是常数,当含有其他镁离子或碳酸根离子的混合溶液中,不一定存在碳酸根离子浓度和镁离子浓度相同,故A错误;
B、氯化镁溶液蒸干得到水解产物,灼烧得到氧化镁,氢氧化镁蒸干灼烧得到氧化镁,碳酸镁溶液加热得到氢氧化钠,灼烧得到氧化镁,将表中三种物质与水混合,加热、灼烧,最终所得的固体产物相同,故B正确;
C、除去粗盐中含有的MgCl2杂质,碳酸镁是微溶于水的物质,不能除净,最佳的除杂试剂为NaOH溶液,故C错误;
D、用石灰水处理含有Mg2+、HCO3-硬水,氢氧化镁溶解度小于碳酸镁,反应生成氢氧化镁沉淀,发生反应的离子方程式为Mg2++HCO3-+Ca2++3OH-═CaCO3↓+Mg(OH)2↓+H2O,故D错误;
故选B.
点评 本题考查沉淀溶解平衡特征,溶度积常数的分析应用,盐类水解产物分析,除杂的原则,注意氢氧化镁溶解度小于碳酸镁,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
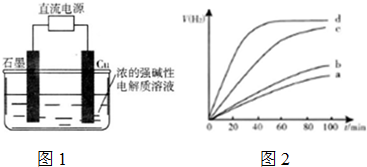
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
前20min的反应平均速率v(H2O)=5.0×10-5 mol.L-1.min -1,达平衡时,至少需要吸收的光能为0.968kJ.
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.

I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| N(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.
8.晶体硅是一种重要的半导体材料,工业上晶体硅的制备流程如下:
石英$→_{高温}^{①}$粗硅$→_{450-500℃}^{②Cl_{2}}$$\stackrel{③精馏}{→}$高纯SiCl4$→_{高温}^{④H_{2}}$高纯硅
在高温条件下,粗硅中的杂质硼、铝、铁、磷等均能与氯气直接反应生成相应的氯化物.
有关物质物理性质:
请回答下列问题:
(1)写出工业上获得粗硅的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)通过精馏(类似多次蒸馏)可得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是Al、P(填写元素符号).
(3)用SiCl4与过量干燥的H2反应制备纯硅,为保证制备纯硅实验的成功,除控制好反应温度外,还需确保实验装置中不能混入空气,原因是氢气与氧气爆炸,硅和氧气高温反应.
石英$→_{高温}^{①}$粗硅$→_{450-500℃}^{②Cl_{2}}$$\stackrel{③精馏}{→}$高纯SiCl4$→_{高温}^{④H_{2}}$高纯硅
在高温条件下,粗硅中的杂质硼、铝、铁、磷等均能与氯气直接反应生成相应的氯化物.
有关物质物理性质:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出工业上获得粗硅的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)通过精馏(类似多次蒸馏)可得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是Al、P(填写元素符号).
(3)用SiCl4与过量干燥的H2反应制备纯硅,为保证制备纯硅实验的成功,除控制好反应温度外,还需确保实验装置中不能混入空气,原因是氢气与氧气爆炸,硅和氧气高温反应.
18.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 非电解质、化合物 | C. | 溶液、胶体 | D. | 分散系、溶液 |
5.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似.下面有关锂及其化合物的性质的叙述不正确的是( )
| A. | 锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2 | |
| B. | Li2CO3受热很难分解 | |
| C. | 在相同温度下,溶解度Li2CO3小于LiHCO3 | |
| D. | 少量的锂保存在固体石蜡中 |
2.下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)$\frac{\underline{\;催化剂\;}}{500℃}$2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)$\frac{\underline{\;催化剂\;}}{500℃}$2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>KMnO4>MnO2 |
3.在100mL含等物质的量的HBr和HI的溶液里通入0.015mol Cl2,有一半Br- 变为Br2.原溶液中HBr和HI的浓度都等于( )
| A. | 0.15 mol/L | B. | 0.10 mol/L | C. | 0.05 mol/L | D. | 0.20 mol/L |
 质的溶液中:①H2CO3②Na2CO3③NaHCO3④NH4HCO3⑤(NH4)2CO3下列关系或者说法正确的是
质的溶液中:①H2CO3②Na2CO3③NaHCO3④NH4HCO3⑤(NH4)2CO3下列关系或者说法正确的是 )的大小关系为②>⑤>③>④>①
)的大小关系为②>⑤>③>④>① )的大小关系为④>③>⑤>②>①
)的大小关系为④>③>⑤>②>①