题目内容
在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
NH2COONH4(s)
 2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是| A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 |
| B.15℃时氨基甲酸铵的分解平衡常数为2.048×10-9(mol/L)3 |
| C.恒温下压缩体积,NH3的体积分数减小 |
| D.再加入一定量氨基甲酸铵,可加快反应速率 |
B
试题分析:A、反应物为固体,生成物全部为气体,从反应开始到平衡状态,气体的平均相对分子质量始终是(2×17+44)/3=26,错误;B、15℃时,平衡气体总浓度为2.4×10-3mol/L,则平衡时氨气浓度是1.6×10-3mol/L,二氧化碳浓度是0.8×10-3 mol/L,K=c2(NH3)c(CO2)=2.048×10-9(mol/L)3,正确;C、恒温下压缩体积,压强增大,平衡虽然逆向移动,但NH3与CO2的物质的量比始终是2:1,所以NH3的体积分数不变,正确;D、氨基甲酸铵是固体,再加入一定量氨基甲酸铵,对反应速率无影响,错误,
答案选B。

练习册系列答案
相关题目
 B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表: CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( ) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是  2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( ) ×100%
×100% ×100%
×100%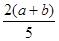 ×100%
×100%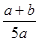 ×100%
×100% N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是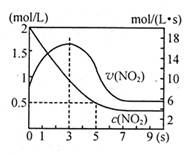
 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表: