题目内容
在一定温度下,反应A2(g) + B2(g) 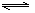 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
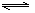 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是 | A.单位时间内生成nmolA2同时生成nmolAB |
| B.容器内的总物质的量不随时间变化 |
| C.单位时间内生成2nmolAB的同时生成nmolB2 |
| D.单位时间内生成nmolA2的同时生成nmolB2 |
C
试题分析:A、由于在反应中A2是反应物,而AB是生成物。若反应达到平衡,则存在单位时间内生成nmolA2同时生成2nmolAB .错误。B、由于该反应是反应前后气体体积相等的反应,所以无论反应是否达到平衡,容器内的总物质的量不随时间变化。错误。C、单位时间内生成2nmolAB的同时必然消耗nmolB2,生成nmolB2 .则相同的时间内B2的消耗物质的量与产生的物质的量相等,物质的浓度不变,因此反应达到平衡。正确。D、A2、B2在方程式的同侧,系数相同,因此在任何时刻都存在:单位时间内生成nmolA2的同时生成nmolB2。故不能作为判断平衡的标准。错误。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是  2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。 2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表: 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;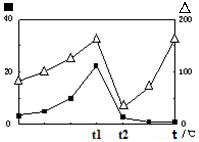 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率) pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是  N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。