题目内容
【题目】一种如图所示的三室微生物燃料电池用来处理废水(废水中高浓度有机物用C6H12O6表示),下列叙述不正确的是

A.a电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.b电极附近的溶液pH增大
C.温度越高,处理废水的效率越高
D.若反应中转移的电子数为NA,则生成标准状况下N2的体积为2.24L
【答案】C
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2![]() +6H2O+10e-=N2↑+12OH-,左边装置电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,据此分析解答。
+6H2O+10e-=N2↑+12OH-,左边装置电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,据此分析解答。
A.a电极是负极,发生失去电子的氧化反应,电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+,A正确;
B.b电极是正极,电极反应式为2![]() +6H2O+10e-=N2↑+12OH-,因此b电极附近的溶液pH增大,B正确;
+6H2O+10e-=N2↑+12OH-,因此b电极附近的溶液pH增大,B正确;
C.高温下能使厌氧菌和反硝化菌等蛋白质变性,所以温度越高,处理废水的效率不一定越高,C错误;
D.根据2![]() +6H2O+10e-=N2↑+12OH-可知若反应中转移的电子数为NA,则生成标准状况下N2的物质的量是0.1mol,其体积为2.24L,D正确;
+6H2O+10e-=N2↑+12OH-可知若反应中转移的电子数为NA,则生成标准状况下N2的物质的量是0.1mol,其体积为2.24L,D正确;
答案选C。

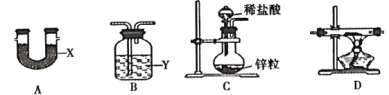
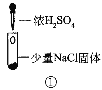
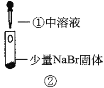
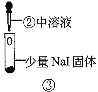
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质