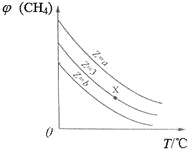
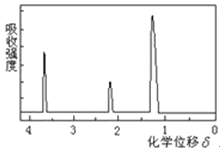
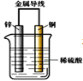
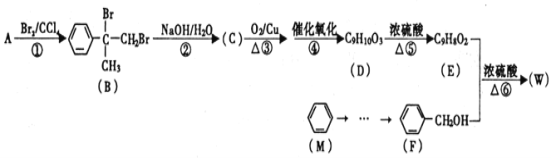
题目内容
【题目】已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-350.5kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s) △H=-90.8kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A. +519.4kJ·mol-1B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1D. -519.4kJ·mol-1
【答案】C
【解析】
①Zn(s)+![]() O2(g)=ZnO(s) △H1=-350.5kJ/mol,②Hg(l)+
O2(g)=ZnO(s) △H1=-350.5kJ/mol,②Hg(l)+![]() O2(g)=HgO(s) △H=-90.8kJ/mol,根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l) △H3=△H1-△H2=(-350.5kJ/mol)-(-90.8kJ/mol)=-259.7 kJ/mol,故选C。
O2(g)=HgO(s) △H=-90.8kJ/mol,根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l) △H3=△H1-△H2=(-350.5kJ/mol)-(-90.8kJ/mol)=-259.7 kJ/mol,故选C。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目