题目内容
【题目】把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是( )
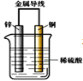
A. 该装置将化学能转变为电能
B. 电流从锌片流向铜片
C. 一段时间后,铜片质量减轻
D. 锌片发生还原反应
【答案】A
【解析】
该装置能自发的进行氧化还原反应Zn+2H+= Zn2++H2↑,能构成原电池,其中锌易失电子发生氧化反应,作负极,铜作正极,结合原电池原理分析解答。
A.该装置是原电池,是将化学能转化为电能的装置,故A正确;
B.该装置中,锌易失电子,作负极,铜作正极,电流从正极铜沿导线流向负极锌,故B错误;
C.铜作正极,正极上发生2H++2e-=H2↑,所以铜片质量不变,故C错误;
D.该装置中,锌片上发生Zn-2e-=Zn2+,属于氧化反应,故D错误;
故选A。

练习册系列答案
相关题目
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大