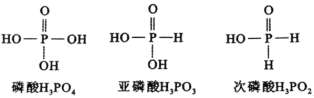
题目内容
【题目】设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),下列说法不正确的是( )
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
【答案】C
【解析】
A. 一分子CH3OH中含有5根共价键,则0.1 mol CH3OH中含共价键数为0.5NA,故A正确;
B. CH3OH与水均可以与金属钠反应生成氢气,反应方程式分别为:2CH3OH+2Na→2CH3ONa+H2↑,2H2O+2Na=2NaOH+H2↑,则可得关系式2CH3OH(或H2O)~2Na~ H2,10.0g 质量分数为32%的CH3OH溶液中n(CH3OH)+n(H2O)=![]() ,4.6g钠的物质的量为0.2mol,由此可知,钠不足,生成氢气物质的量为0.1mol,即产生H2分子数为0.1NA,故B正确;
,4.6g钠的物质的量为0.2mol,由此可知,钠不足,生成氢气物质的量为0.1mol,即产生H2分子数为0.1NA,故B正确;
C. 该反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)为可逆反应,则1 mol CH3OH与足量的H2O反应,得到CO2分子数小于NA,故C错误;
CO2(g)+3H2(g)为可逆反应,则1 mol CH3OH与足量的H2O反应,得到CO2分子数小于NA,故C错误;
D. 在该反应中,碳的化合价从-2价升高到+4价,氢的化合价从+1价降低为0价,当1mol甲醇与1mol水反应时,转移6mol电子,则每消耗0.1 mol CH3OH时,转移电子数为0.6NA,故D正确;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钛合金在国防、医用器材领域有重要应用,某研究小组利用钛铁矿[主要成分偏钛酸亚铁(FeTiO3),含SiO2、FeO 杂质]制取TiCl4,然后进一步制备金属钛,流程如下∶

已知∶
a.发生的主要反应方程式如下∶
FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O TiOSO4+2H2O
TiOSO4+FeSO4+2H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4
H2TiO3↓+H2SO4
H2TiO3![]() TiO2+H2O
TiO2+H2O
b.部分物质的性质∶
TiCl4 | SiCl4 | FeCl3 | TiO2 | |
沸点/°C | 136.4 | 57.6 | 315 | / |
其它性质 | 极易水解 | / | / | 不溶于水 |
请回答∶
(1)步骤II抽滤时选用了玻璃砂漏斗,请说明选择的理由______。
(2)步骤III为了除去浸取液中的铁元素杂质并回收FeSO47H2O。往浸取液中加入铁粉至溶液中的Fe3+完全转化,然后抽滤,滤液用冰盐水快速冷却至FeSO47H2O结晶析出,再次抽滤并洗涤。下列说法正确的是____。
A.杂质Fe3+可能是在实验过程中氧化生成的
B.再次抽滤获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却有利于形成较大的晶体颗粒
D.再次抽滤后的洗涤应选用蒸馏水进行多次洗涤
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化。操作步骤如下∶取一部分步骤III获得的滤液→(________)→(________)→(________)→(_________)→抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。
①将下列操作按合理顺序填入以上空格。
a.静置沉降后,用倾析法除去上层水;
b.逐滴加入到沸水中并不停搅拌,继续煮沸约10 min;
c.用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀;
d.慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积);
②写出操作c中用热水洗涤沉淀的具体过程_____。
(4)①另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用步骤V的反应原理获得TiCl4.。产品中含有SiCl4、FeCl3等杂质,可通过精馏的方法获得高纯TiCl4,以下说法正确的是______。

A.收集TiCl4时,仪器a中的温度应控制为136.4°C
B. b处温度计的水银球的上沿和支管口的下沿齐平
C.精馏结束时留在圆底烧瓶中的主要成分是FeCl3和Si
D.装置c中的冷凝水应该“下口进、上口出”
E.可以用水浴加热的方法精馏获得TiCl4
②d处装有碱石灰的干燥管,作用是________。