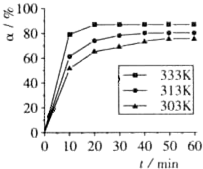
题目内容
19. 电解饱和食盐水制取氯气和烧碱(氯碱工业)
电解饱和食盐水制取氯气和烧碱(氯碱工业)电解前应除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质离子
电解反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
如何检验阳极产生的气体:用湿润的淀粉KI试纸检验气体,如果变蓝色,说明是氯气.
分析 根据电解池的工作原理,在阳极上是氯离子失电子生成氯气,在阴极上生成氢气和氢氧化钠,氯气具有氧化性,能使湿润的淀粉碘化钾显示蓝色,据此回答判断.
解答 解:根据电解池的工作原理,在阳极上是氯离子失电子生成氯气,在阴极上生成氢气和氢氧化钠,总反应为:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,氯气具有氧化性,能使湿润的淀粉碘化钾显示蓝色,检验的方法:用湿润的淀粉KI试纸检验气体,如果变蓝色,说明是氯气.
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;用湿润的淀粉KI试纸检验气体,如果变蓝色,说明是氯气.
点评 本题考查学生电解池的工作原理以及氯气的性质知识,属于基本知识的考查,难度中等.

练习册系列答案
相关题目
4.实验室中少量金属钠可保存在( )
| A. | 四氯化碳 | B. | 汽油 | C. | 煤油 | D. | 水 |
7.下列关于漂白粉的叙述正确的是( )
| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉的有效成分Ca(ClO)2不稳定,易分解 | |
| D. | 漂白粉的主要成分是CaCl2 |
14.下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是( )
| A. | v(NH3)=0.15 mol/L•min | B. | v(H2)=0.1 mol/L•min | ||
| C. | v(N2)=0.1 mol/L•min | D. | v(N2)=0.002 mol/L•s |
4.下列叙述不正确的是( )
①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力③离子键只存在于化合物中 ④仅由非金属元素不可能形成离子化合物.⑤通常,活泼金属与活泼非金属形成离子化合物.
①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力③离子键只存在于化合物中 ④仅由非金属元素不可能形成离子化合物.⑤通常,活泼金属与活泼非金属形成离子化合物.
| A. | ①②④ | B. | ①②③④ | C. | ③④⑤ | D. | 全部都不正确 |
8.下列离子方程式正确的是( )
| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
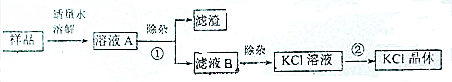
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题: