题目内容
4.下列叙述不正确的是( )①分子内一定含有共价键 ②离子键就是阴、阳离子的静电引力③离子键只存在于化合物中 ④仅由非金属元素不可能形成离子化合物.⑤通常,活泼金属与活泼非金属形成离子化合物.
| A. | ①②④ | B. | ①②③④ | C. | ③④⑤ | D. | 全部都不正确 |
分析 ①稀有气体分子内不含化学键;
②离子键就是阴、阳离子的静电作用力;
③离子键只存在于离子化合物中;
④仅由非金属元素可能形成离子化合物;
⑤通常,活泼金属易失去电子,活泼非金属易得到电子,而形成离子化合物.
解答 解:①稀有气体分子内不含化学键,而多原子分子中含化学键,故错误;
②离子键就是阴、阳离子的静电作用力,含吸引和排斥力,故错误;
③离子键只存在于离子化合物中,则离子键只存在于化合物中,故正确;
④仅由非金属元素可能形成离子化合物,如铵盐中只存在非金属元素,为离子化合物,故错误;
⑤通常,活泼金属易失去电子,活泼非金属易得到电子,而形成离子化合物,如NaCl为离子化合物,故正确;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合常见的实例分析,题目难度不大.

练习册系列答案
相关题目
9.下列物质中属于氧化物的是( )
| A. | O2 | B. | Na2O | C. | NaCl | D. | SO2 |
12.120℃时,0.1mol两种气态烃组成的混合气体完全燃烧后得到8.8gCO2和3.6g水,则这两种烃可能是下列的( )
| A. | CH4和C3H4 | B. | C2H2和C2H6 | C. | CH4和C3H6 | D. | CH4和C2H6 |
9.Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如表所示.其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图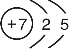 .
.
(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
| X | ||||
| Y | Z | W |
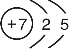 .
.(2)W与Z的氢化物中,较稳定的是HCl(用化学式表示)
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示)
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si+6OH--4e-=SiO32-+3H2O;
(5)已知:①C(s)+O2(g)=CO2(g)△H1;
②CO2(g)+C(s)=2CO(g)△H2;
③Si(s)+O2(g)=SiO2(s)△H3.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=△H1+△H2-△H3;
(6)25℃时,往a mol•L-1NH3的水溶液中滴加0.1mol•L-1H2SO4溶液,滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”);实验测得a mol•L-1NH3的水溶液的pH值为12,求此氨水的电离平衡常数Kb=$\frac{1{0}^{-4}}{(a=1{0}^{-2})}$mol•L-1(用含a的代数式表示).
16.将一定量的有机物A溶于烧碱溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液红色变浅,再向其中加入盐酸,显酸性,并析出白色晶体;取少量上述晶体放到FeCl3溶液中,溶液呈紫色.则有机物A可能是( )
| A. |  | B. |  | C. | 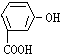 | D. |  |
13.向50gCuSO4溶液中放入一小块Na,待反应完全后,过滤,得到仍显蓝色的溶液44.6g,则投入的Na的质量为( )
| A. | 4.6g | B. | 4.1g | C. | 6.9 g | D. | 9.2g |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
 电解饱和食盐水制取氯气和烧碱(氯碱工业)
电解饱和食盐水制取氯气和烧碱(氯碱工业)