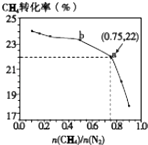
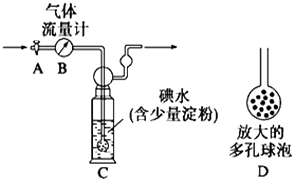
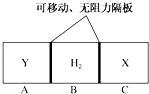
题目内容
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A. Mg为电池的正极
B. 负极反应为AgCl+e-=Ag+Cl-
C. 不能被KCl 溶液激活
D. 可用于海上应急照明供电
【答案】D
【解析】
A、根据电极总电极反应式,化合价升高的作负极,Mg作负极,故错误;
B、AgCl作正极,故错误;
C、KCl属于电解质,能被激活,故错误;
D、利用海水作电解质溶液,故正确。
故选D。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
(1)实验步骤
①用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
②用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
③读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.![]()
④滴定.当时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(2)实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.