题目内容
【题目】下列说法正确的是 ( )
A. 1mol氢 B. 1.5molH2O C. 2mol铁钉 D. 3mol西瓜
【答案】B
【解析】试题分析:mol表示微观粒子,B项符合;C、D选项是宏观物质,不适合;A选项氢含义不明确,mol后紧跟微粒符号。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
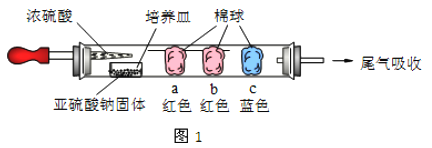
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
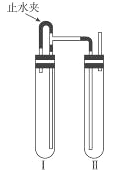
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。