题目内容
3.6g某金属跟足量盐酸反应产生0.5g氢气,生成的+2价金属氯化物中共有11.5 mol电子,则该金属在元素周期表中的位置是( )| A. | 第二周期ⅡA族 | B. | 第三周期ⅡA族 | C. | 第三周期ⅢA族 | D. | 第二周期ⅢA族 |
分析 金属与酸反应置换出氢气,金属提供电子,根据氧化还原反应电子转移守恒,计算金属的物质的量.结合生成的氯化物中含有电子的物质的量,求出金属含有的电子数,进而确定金属元素在元素周期表中的位置.
解答 解:氢气的物质的量为$\frac{0.5g}{2g/mol}$=0.25mol;
令金属为nmol,根据电子转移守恒有:
2×n=0.25mol×2,解得n=0.25,
生成的氯化物中共有11.5mol电子,则1mol氯化物中含有的电子数为$\frac{11.5}{0.25}$=46mol,则1个M含有的电子数为46-17×2=12;
所以M为12号元素Mg,位于第三周期ⅡA族;
故选:B
点评 本题考查通过计算推断元素,难度中等,注意从氧化剂、还原剂得失电子的数目关系判断金属元素原子失去电子数目是解题的关键.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
16.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含离子数约为1.806×1024 | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | N2H4分子中极性键和非极性键的比值为1:4 |
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
8.下列有机物中不属于卤代烃的是( )
| A. | 乙苯 | B. | 全氟丙烷 | C. | 氯乙烷 | D. | 氟里昂 |
15.央视3•15晚会曝光,在液化石油气中掺混二甲醚的事件.二甲醚(常压下沸点-24.9℃)是一种可溶于水的化工原料,β4用作一些燃料的替代品,其结构式为 .下列有关二甲醚的叙述正确的是( )
.下列有关二甲醚的叙述正确的是( )
 .下列有关二甲醚的叙述正确的是( )
.下列有关二甲醚的叙述正确的是( )| A. | 二甲醚是一种有机物,属于非电解质 | |
| B. | 4.6g该物质中含有共价键的数目为2×6.02×1022 | |
| C. | 二甲醚和乙醇互为同分异构体且和甲醇互为同系物 | |
| D. | 标准状况下,燃烧11.2L二甲醚一定生成22.4LCO2 |
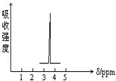 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰. 实验目的的是
实验目的的是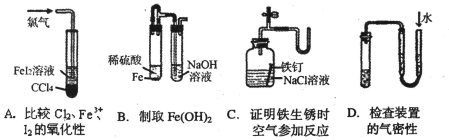
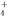 、Al3+、AlO
、Al3+、AlO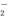 、SO
、SO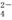 、SiO
、SiO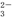 、CO
、CO 的离子是,肯定不存在的离子是。
的离子是,肯定不存在的离子是。