题目内容
14.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.(1)图中所示的反应是放热(填“吸热”或“放热”)反应,该反应需要(填“需要”或“不需要”)加热,该反应的△H=(E2-E1)kJ•mol-1(用含E1、E2的代数式表示).
(2)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol该反应的活化能为167.2kJ/mol,则其逆反应的活化能为409.0KJ/mol.
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因使用了催化剂.
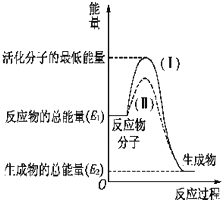
分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响所以速率的元素分析判断.
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量,即△H=(E2-E1)kJ•mol-1,
故答案为:放热;需要;(E2-E1)kJ•mol-1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol,
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,故答案为:使用了催化剂.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,题目难度不大,读懂图象,焓变和活化能计算方法的理解是解题的关键.

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 1L 1mol•L-1 K2Cr2O2溶液中Cr2O72-的数目为NA | |
| B. | 1mol C60F60分子中碳原子之间共用电子对数目为90NA | |
| C. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| D. | 标准状况下,2.24L Cl2完全溶于水,转移电子数为0.1NA |
| A. | 该反应的氧化剂只有Cu2O | |
| B. | Cu既是氧化产物,又是还原产物 | |
| C. | Cu2S在反应中既是氧化剂又是还原剂 | |
| D. | 还原产物与氧化产物的物质的量之比为1:6 |
| A. | 聚丙烯结构简式: | B. | 四氯化碳的电子式为: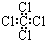 | ||
| C. | 丙烷分子的比例模型为: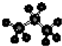 | D. | 2-乙基-1,3-丁二烯的键线式: |
| A. | 负极反应为:O2+2H2O+4e═4OH- | |
| B. | 负极反应为:CH4+10OH--8e═CO32-+7H2O | |
| C. | 放电时溶液中的阳离子向负极移动 | |
| D. | 随放电的进行,溶液的pH值不变 |
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
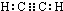 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极发生的电极反应式为O2+2H2O+4e-=4OH-;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.  ,Na在氧气中完全燃烧所得产物的电子式为
,Na在氧气中完全燃烧所得产物的电子式为
 .
. .
. .
.