题目内容
(1)某温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应.
①用SO2表示该反应的反应速率为
②O2的转化率为
③平衡时体系中SO3的体积分数为
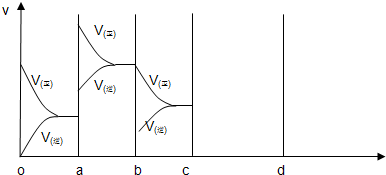
(2)下图表示在密闭容器中反应:CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,由于改变某一条件而引起反应速度(v)和化学平衡的变化情况,
①a b过程中改变的条件可能是
②bc段,平衡
③若缩小容器体积使体系压强增大时,平衡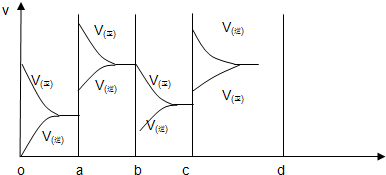
 .
.
①用SO2表示该反应的反应速率为
0.03mol.L-1min-1
0.03mol.L-1min-1
,用O2表示的速率为:0.015mol.L-1min-1
0.015mol.L-1min-1
②O2的转化率为
33.3%
33.3%
③平衡时体系中SO3的体积分数为
37.5%
37.5%
(2)下图表示在密闭容器中反应:CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,由于改变某一条件而引起反应速度(v)和化学平衡的变化情况,
①a b过程中改变的条件可能是
降温
降温
;(选填:升温、降温、加压(缩小容器体积))②bc段,平衡
正反应方向移动
正反应方向移动
(选填“正反应方向移动”“逆反应方向移动”“不移动”),③若缩小容器体积使体系压强增大时,平衡
逆反应方向移动
逆反应方向移动
(选填“正反应方向移动”“逆反应方向移动”“不移动”),反应速度变化情况在c-d段作出


分析:(1)依据化学判断的三段式列式计算,根据物质表示的反应速率=
;转化率=
×100%;求的平衡混合气体中各物质的量,计算三氧化硫的体积分数;
(2)根据化学平衡的特征,依据影响化学平衡的条件判断平衡移动方向,方向速率时间图象,方向条件改变和反应进行方向.
| △C |
| t |
| 消耗量 |
| 起始量 |
(2)根据化学平衡的特征,依据影响化学平衡的条件判断平衡移动方向,方向速率时间图象,方向条件改变和反应进行方向.
解答:解:(1)某温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应,依据化学平衡的三段式列式
2SO2+O2=2SO3
起始量(mol) 5 4.5 0
变化量(mol) 3 1.5 3
平衡量(mol) 2 3 3
①用SO2表示该反应的反应速率=
=0.03mol.L-1min-1,用O2表示的速率=
=0.015 mol.L-1min-1 ,故答案为:0.03mol.L-1min-1;0.015mol.L-1min-1;
②O2的转化率=
×100%=33.3%,故答案为:33.3%;
③平衡时体系中SO3的体积分数为混合气体中物质的量的分数=
×100%=37.5%,故答案为:37.5%;
(2)CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,反应是吸热反应,反应前后气体体积增大;
①分析图象可知,改变条件正逆速率都增大,且正反应速率大于逆反应速率,所以改变条件使平衡正向进行,升温符合,降温速率不符合,增大压强速率符合,平衡进行方向不符合,
故答案为:升温;
②依据图象分析bc段是比ab段速率减小,且改变条件后正反应速率大于逆反应速率,所以平衡正向进行,故答案为:正反应方向移动;
③若缩小容器体积使体系压强增大时,平衡向气体体积减小的方向移动,反应是气体体积增大的反应,所以平衡向逆向进行,故答案为:逆反应方向移动;增大压强正逆反应速率都增大,逆反应速率增大比正反应速率增大的多,在图象中画出速率时间图象为:
 故答案为:
故答案为: .
.
2SO2+O2=2SO3
起始量(mol) 5 4.5 0
变化量(mol) 3 1.5 3
平衡量(mol) 2 3 3
①用SO2表示该反应的反应速率=
| ||
| 10min |
| ||
| 10min |
②O2的转化率=
| 1.5mol |
| 4.5mol |
③平衡时体系中SO3的体积分数为混合气体中物质的量的分数=
| 3mol |
| 2mol+3mol+3mol |
(2)CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,反应是吸热反应,反应前后气体体积增大;
①分析图象可知,改变条件正逆速率都增大,且正反应速率大于逆反应速率,所以改变条件使平衡正向进行,升温符合,降温速率不符合,增大压强速率符合,平衡进行方向不符合,
故答案为:升温;
②依据图象分析bc段是比ab段速率减小,且改变条件后正反应速率大于逆反应速率,所以平衡正向进行,故答案为:正反应方向移动;
③若缩小容器体积使体系压强增大时,平衡向气体体积减小的方向移动,反应是气体体积增大的反应,所以平衡向逆向进行,故答案为:逆反应方向移动;增大压强正逆反应速率都增大,逆反应速率增大比正反应速率增大的多,在图象中画出速率时间图象为:
 故答案为:
故答案为: .
.点评:本题考查了化学反应速率的计算应用,影响条件的判断,化学平衡的计算,化学平衡的影响因素判断,转化率等概念的分析计算,题目难度较小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-