题目内容
【题目】某同学设计了如图的实验:
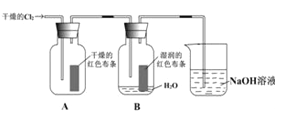
(1)若贮有氯气的钢瓶损坏,造成氯气泄露,在场人员除了采取有效措施外,其他人员应____________(选字母).
A、向低洼处转移 B、向地势高处转移 C、原地不动
(2)装置中通入Cl2后,集气瓶A中干燥的红色布条无变化,集气瓶B中湿润的红色布条____________.由此可得出的结论是____________.
(3)上述装置烧杯中盛放溶液的作用是____________.写出烧杯中发生反应的化学方程式____________.
(4)Fe在Cl2中燃烧,生成棕褐色的烟,要检验其溶液中是否存在Fe3+,可向其中滴入几滴KSCN溶液,观察到的现象是____________.若先向溶液中加入少量铁粉,充分反应后再滴入几滴KSCN溶液,结果观察不到此现象,原因是(用离子方程式表示) .
【答案】(1)B;(2)褪色;干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(3)吸收尾气,防止污染空气;Cl2+2NaOH═NaCl+NaClO+H2O;
(4)溶液变为红色;2Fe3++Fe=3Fe2+
【解析】
试题分析:(1)由于氯气的密度大于空气的密度,因此氯气泄漏时,低洼处氯气浓度大,因此其他人员应向地势高处转移,故答案B;(2)装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色,由此可得出结论,干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;(3)NaOH溶液的作用是吸收尾气,防止污染空气;反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;(4)向溶液中滴入几滴KSCN溶液,溶液变为血红色,证明溶液中有Fe3+,若先向溶液中加入少量铁粉,充分反应后再滴入几滴KSCN溶液,结果观察不到此现象,原因是Fe3+被铁粉还原为Fe2+,离子方程式为:2Fe3++Fe=3Fe2+。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案