题目内容
【题目】下表列出了A~X元素在周期表中的位置,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)这些元素中,化学性质最不活泼的是:______(用具体元素符号或化学式等化学用语填空,下同)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物是________,该化合物与性质表现为两性氢氧化物的物质反应的离子方程式为__________________________________。
(3)G元素与T元素形成的化合物属于_______(填“共价”或“离子”)化合物。
(4)D、E、G三种元素按原子半径由大到小的顺序排列__________________。
(5)A元素的单质分别与M元素的单质、R元素的单质反应生成甲、乙,甲、乙常温下均为气态,且两者相遇时可化合成丙。化合物丙的电子式为_____________。
(6)R元素和T元素两者核电荷数之差是_____。
【答案】Ar HClO4 3H++Al(OH)3= Al3++3H2O 离子 r(K)>r(Na)>r(Mg) 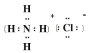 18
18
【解析】
依据元素在周期表中的位置关系可知,A为H元素,L为C元素,M为N元素,Q为O元素,D为Na元素,G为Mg元素,J为Al元素,R为Cl元素,X为Ar元素,E为K元素,T为Br元素,根据元素周期律及物质的结构与性质作答。
根据上述分析可知,
(1)这些元素中,Ar最外层为8电子稳定结构,化学性质最不活泼,故答案为:Ar;
(2)非金属性越强,最高价氧化物对应的水化物酸性越强,因F无正价,则酸性最强的是HClO4;性质表现为两性氢氧化物的物质为氢氧化铝,两者发生中和反应,其离子方程式为:3H++Al(OH)3= Al3++3H2O;
(3)G元素与T元素形成的化合物MgBr2,是由溴离子与镁离子构成,属于离子化合物;
(4)同周期中元素原子半径从左到右依次减小,同一主族,元素原子半径从上到下依次增大,则D、E、G三种元素按原子半径由大到小的顺序排列为:r(K)>r(Na)>r(Mg);
(5)氢气和氮气、氯气分别反应转化为氨气、氯化氢,两者在常温下相遇会生成氯化铵,其电子式为: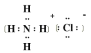 ;
;
(6)氯与溴处于同主族,氯位于第三周期,溴位于第四周期,两者核电荷数之差为18。