题目内容
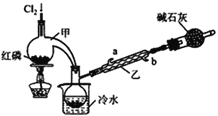
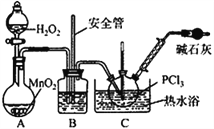
【题目】下列物质能与SiO2起反应的是
①浓H2SO4 ②H2O ③盐酸 ④HF ⑤KOH溶液 ⑥氧化钙
A. ①②⑥ B. ②④ C. ④⑤⑥ D. ③④⑤⑥
【答案】C
【解析】分析:根据二氧化硅性质分析判断。
详解:①二氧化硅与浓H2SO4不反应;②二氧化硅是酸性氧化物,不溶于水,与水不反应;③二氧化硅与盐酸不反应;④HF与二氧化硅反应生成四氟化硅和水;⑤二氧化硅是酸性氧化物,与KOH溶液反应生成硅酸钾和水;⑥氧化钙与二氧化硅在高温下反应生成硅酸钙,则④⑤⑥正确,答案选C。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】下表列出了A~X元素在周期表中的位置,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)这些元素中,化学性质最不活泼的是:______(用具体元素符号或化学式等化学用语填空,下同)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物是________,该化合物与性质表现为两性氢氧化物的物质反应的离子方程式为__________________________________。
(3)G元素与T元素形成的化合物属于_______(填“共价”或“离子”)化合物。
(4)D、E、G三种元素按原子半径由大到小的顺序排列__________________。
(5)A元素的单质分别与M元素的单质、R元素的单质反应生成甲、乙,甲、乙常温下均为气态,且两者相遇时可化合成丙。化合物丙的电子式为_____________。
(6)R元素和T元素两者核电荷数之差是_____。
【题目】汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=___________,t1℃时该反应的平衡常数K=________。
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
则处理汽车尾气反应中的a=__________。
(5)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
NO | N2 | CO2 | |
起始浓度/mol·L-1 | 0.10 | 0 | 0 |
平衡浓度/mol·L-1 | 0.04 | 0.03 | 0.03 |
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则ΔH4_______0(填“ >”、“=”或“<”)。