题目内容
【题目】将反应IO3-+5I-+6H+![]() 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。
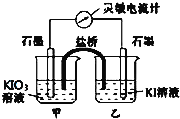
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____,工作过程中关于电流计的读数,下列说法正确的是____(填编号)。
a.电流计读数逐渐减小 b.电流计读数有可能变为0
c.电流计读数一直不变 d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_______(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为______,电流计指针向_______(填“左”、“右”)偏转。
【答案】(1)2IO3-+10e-+12H+ = I2+6H2O,a、b;(2)甲、乙;(3)I2+2e-= 2I-,左。
【解析】
试题(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,根据方程式可知碘酸根得到电子,发生还原反应,则此时甲池中发生的电极反应式为2IO3-+10e-+12H+ = I2+6H2O。a.随着反应的进行,离子的浓度逐渐减小,则电流计读数逐渐减小,a正确;b.反应达到平衡状态时电流计读数变为0,b正确;根据以上分析可知cd错误,答案选ab。
(2)乙中碘离子失去电子转化为单质碘,甲中碘酸根得到电子转化为电子碘,碘遇淀粉显蓝色,则如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,溶液变蓝的烧杯是甲、乙。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时甲中碘失去电子转化为碘酸根,即甲是负极,乙池中碘得到电子转化为碘离子,乙是正极,发生的电极反应式为I2+2e-= 2I-。由于正负极互换,则电流计指针向左偏转。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了A~X元素在周期表中的位置,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)这些元素中,化学性质最不活泼的是:______(用具体元素符号或化学式等化学用语填空,下同)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物是________,该化合物与性质表现为两性氢氧化物的物质反应的离子方程式为__________________________________。
(3)G元素与T元素形成的化合物属于_______(填“共价”或“离子”)化合物。
(4)D、E、G三种元素按原子半径由大到小的顺序排列__________________。
(5)A元素的单质分别与M元素的单质、R元素的单质反应生成甲、乙,甲、乙常温下均为气态,且两者相遇时可化合成丙。化合物丙的电子式为_____________。
(6)R元素和T元素两者核电荷数之差是_____。


