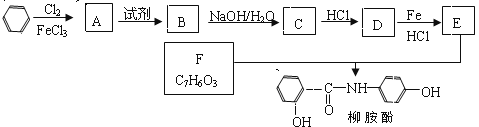
题目内容
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)Co元素在周期表中的位置是4周期________族。基态Co原子的简化电子排布式为_________。
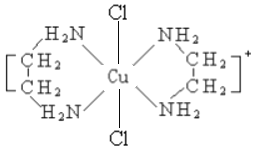
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下左图所示,中心离子的配位数为_______,配合物晶体中可能存在的作用力有___________。
A 离子键 B 极性共价键 C 非极性共价键 D 配位键 E 氢键
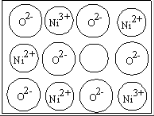
(3)天然氧化镍晶体中总是存在晶体缺陷,如图所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
(4)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)。

【答案】VIII [Ar]3d74s2 sp3 6 ABCDE 8:3 ![]()
【解析】
(1)钴为27号元素,据此书写基态Co原子电子排布式并判断在元素周期表中的位置;
(2)根据杂化轨道数=共价键数+孤电子对数分析判断N原子的杂化类型;根据配离子的结构图判断配位数;该配合物晶体属于离子化合物,结合配体为乙二胺和氯原子分析判断可能存在的作用力;
(3)根据NiXO中化合价代数和为零列式计算;
(4)根据 ,计算含有的原子数,结合小平行四边形的面积计算。
,计算含有的原子数,结合小平行四边形的面积计算。
(1)钴为27号元素,基态Co原子的价电子为其3d、4s能级上的电子,其简化电子排布式为[Ar]3d74s2,位于元素周期表的第四周期Ⅷ族,故答案为:Ⅷ;[Ar]3d74s2;
(2)乙二胺分子中N原子成键时,形成三根共价键,本身含有一对孤电子对,杂化轨道数=共价键数+孤电子对数,则N原子的杂化轨道数目为4,根据杂化轨道理论,N原子为sp3杂化;根据配离子的结构图,该配离子与2个乙二胺分子中的4个N原子形成4个配位键,与2个氯原子形成2个配位键,配位数为6;该配合物晶体属于离子化合物,含有离子键,有机配体中含有共价键,N和C之间是极性键,C与C之间是非极性键,中心原子与配离子间存在配位键,乙二胺分子间还可能形成氢键,故答案为:sp3;6;ABCDE;
(3)设晶体中Ni2﹢与Ni3﹢的最简整数比为x∶y,根据NiXO中化合价代数和为零可知![]() ×0.88=2,由此解得x∶y=8∶3,故答案为:8∶3;
×0.88=2,由此解得x∶y=8∶3,故答案为:8∶3;
(4)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图 所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,含有的O原子数=
所示,相邻的3个圆中心连线为正三角形,三角形的边长为2apm,每个三角形含有一个Ni原子,含有的O原子数=![]() ×3=
×3=![]() ,三角形的面积=[
,三角形的面积=[![]() ×2a×2a×sin60°×10-24]m2=
×2a×2a×sin60°×10-24]m2=![]() ×10-24 a2 m2,如图
×10-24 a2 m2,如图 实际上每个Ni原子被两个小三角形包含,小平行四边形面积为2
实际上每个Ni原子被两个小三角形包含,小平行四边形面积为2![]() ×10-24 a2m2,O原子个数=
×10-24 a2m2,O原子个数=![]() ×2=1,每平方米面积上分散的该晶体的质量=
×2=1,每平方米面积上分散的该晶体的质量=![]() ×
×![]() g=
g=![]() g=
g=![]() g,故答案为:
g,故答案为:![]() 。
。