��Ŀ����
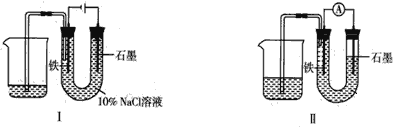
����Ŀ����֪���淴ӦAsO43-+2I-+2H+![]() AsO33-+I2+H2O���������ͼװ�ã���������������
AsO33-+I2+H2O���������ͼװ�ã���������������
����(��)�ձ�����μ���Ũ���ᣬ��������(G)ָ��ƫת����������(��)�ձ��еμ�40��NaOH��Һ����������ָ��������ƫת�����෴���ش���������

(1)�����������У�C1��Ϊ__________����C2���Ϸ����ķ�ӦΪ______________________
(2)�����������������е�_________��������(I)�ձ���C1���Ϸ����ķ�ӦΪ_____________
(3)�����������ɵ��ұ����װ�ã�д������ܷ�Ӧ����ʽ__________________________________
(4)�����������ɵ�⾫��ͭװ�ã��ڲ�������������C2�����ӵ�Ϊ_________�缫�����һ��ʱ�����Һ��CuSO4��Һ��Ũ��_____________(�������������С������������)
���𰸡�
(1)����AsO43-+2H++2e-=AsO33-+H2O��
(2)����I2+2e-=2I-��
(3)2Al2O3![]() 4Al+3O2����
4Al+3O2����
(4)��ͭ����С��
��������
���������(1)�������з���AsO43-+2I-+2H+![]() AsO33-+I2+H2O��C1��Ϊ����������2I--2e-=I2��C2Ϊ����������ԭ��Ӧ���缫��ӦΪAsO42-+2H++2e-=AsO32-+H2O���ʴ�Ϊ������AsO43-+2H++2e-=AsO33-+H2O��
AsO33-+I2+H2O��C1��Ϊ����������2I--2e-=I2��C2Ϊ����������ԭ��Ӧ���缫��ӦΪAsO42-+2H++2e-=AsO32-+H2O���ʴ�Ϊ������AsO43-+2H++2e-=AsO33-+H2O��
(2)�����������з���AsO33-+I2+2OH-![]() AsO43-+2I-+H2O��C2��Ϊ�������缫��ӦΪAsO33-+H2O-2e-=AsO43-+2H+��C1Ϊ������C1���Ϸ����ķ�ӦΪI2+2e-=2I-�������ɸ������������������еļ�������I�ձ��ƶ����ʴ�Ϊ������I2+2e-=2I-��
AsO43-+2I-+H2O��C2��Ϊ�������缫��ӦΪAsO33-+H2O-2e-=AsO43-+2H+��C1Ϊ������C1���Ϸ����ķ�ӦΪI2+2e-=2I-�������ɸ������������������еļ�������I�ձ��ƶ����ʴ�Ϊ������I2+2e-=2I-��
(3)���������ұ�����ķ�Ӧ����ʽΪ2Al2O3![]() 4Al+3O2�����ʴ�Ϊ��2Al2O3
4Al+3O2�����ʴ�Ϊ��2Al2O3![]() 4Al+3O2����
4Al+3O2����
(4)���������ɵ�⾫��ͭװ�ã�C1������������C2����������������ӦΪ��ͭ������ӦΪ��ͭ�������ϱ�ͭ���õĽ�������п�����Ƚ����ŵ������Һ��������ֻ��ͭ���ӷŵ磬���һ��ʱ�����Һ��CuSO4��Һ��Ũ����С���ʴ�Ϊ����ͭ����С��

����Ŀ��ǰ������Ԫ��A��B��C��D��E��ԭ��������������̬Aԭ�Ӻ������ռ��3���������̬Bԭ�Ӻ������ռ��3���ܼ���ÿ���ܼ��ϵ�������ȣ�C��˫ԭ�ӵ��ʷ�����������������Ŀ֮��Ϊ1:2��D����������ϼۺ�������ϼ�֮�͵���4����̬Eԭ�Ӻ�����6��δ�ɶԵ��ӡ�
��1����̬Eԭ�ӵĺ�������Ų�ʽΪ______����̬Dԭ�Ӻ������ռ�ݵ�������ߵ��ܼ�����Ϊ_____________��
��2��AԪ�صĸ������������£�
�ܼ�(I) | I1 | I2 | I3 | I4 | I5 |
������/kJ��mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
�����ϱ�����֪�������������ӵĵ������У�I3��I4֮������������Ҫԭ����__________��
��3��A��B��CԪ�ص�����������Ӧ��ˮ��������������ǿ����ԭ����________��
��4����Ԫ����A��B��CԪ����ɵĹ��۷���ACl3��BCl4��CCl3�У�����ԭ�Ӳ���sp3�ӻ������幹��Ϊ�����ε���_______(�����ʽ)��
��5��(DC)4Ϊ��ɫ�Թ��壬����ɫ��ЧӦ������-30��ʱΪ����ɫ��������Ϊ�Ȼ�ɫ������100��ʱΪ���ɫ���ڵ���ɫ���Ȼ�ɫ�����ɫ��ת���У��ƻ�����������____���ڳ�ѹ�£�(DC)4����130���ֽ�Ϊ��Ӧ�ĵ��ʣ���һ�仯���ƻ�����������_______����B��C��D�ļ���̬�⻯���У����ڷǼ��Է��ӵ���______(�����ʽ����ͬ)������Cu2+��Zn2+��Ag+���γ������ӵ���_______________��
��6��A��C�γ��������壬����ṹ���ƽ��ʯ����ͼ��ʾ����֪���þ����ܶ�Ϊ��g���M-3��NA��������٤��������ֵ��
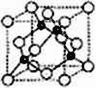
�ٸþ���Ļ�ѧʽΪ__________��
���ڸþ����У�A��C�γɹ��ۼ��ļ���(d)Ϊ_____pm��